Лекция 2. Физические основы радиобиологии
1. Строение вещества.
2. Явление радиоактивного распада
3. Радиоактивные превращения. (a, b, p - распады, g-излучение). Взаимодействие ионизирующих излучений с веществом
Все вещества состоят из атомов - нейтральных частиц размером 10-10 м. Атом состоит из ядра и электронной оболочки, содержащей Z электронов. Масса атомной оболочки ничтожно мала по сравнению с массой ядра. Заряд ядра равен +Z. Атомное ядро содержит Z протонов и А - Z нейтронов, всего А частиц: А= Zp + (A-Z) n.
В 1932 г В.Гейзенберг ввел представление о нуклоне - частице, два разных состояния которой представляют протон и нейтрон. Общее число нуклонов в ядре называется массовым числом (А). В ядерных превращениях общее число нуклонов в ядре не меняется. Число протонов в ядре - Z; число нейтронов: А - Z º N; Z совпадает с порядковым номером химического элемента и равен числу электронов в атомной оболочке.
Атомное ядро - весьма устойчивое образование с энергией связи ~ 10 МэВ на одну частицу.
Электрон, 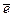 , открыт в 1897 г Дж. Дж. Томсоном. Заряд электрона равен 1,602 × 10-19Кл; масса составляет 9,1× 10-31г или 0,511 кэВ. Электрон является наилегчайшей из всех заряженных частиц, он абсолютно стабилен, во всяком случае его период полураспада превышает 2 × 1022 лет.
, открыт в 1897 г Дж. Дж. Томсоном. Заряд электрона равен 1,602 × 10-19Кл; масса составляет 9,1× 10-31г или 0,511 кэВ. Электрон является наилегчайшей из всех заряженных частиц, он абсолютно стабилен, во всяком случае его период полураспада превышает 2 × 1022 лет.
Протон, р, был открыт в 1919 г Э. Резерфордом. Масса протона на три порядка больше массы электрона (в 1836 раз) и составляет 1,67 × 10-27 кг или 938,3 МэВ. Протон несет положительный заряд, равный заряду электрона (расхождение зарядов р и 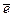 составляет 10- 21!). Факт строгой квантованности электрического заряда - одна из великих загадок Природы. Протон является составной частицей, обладающей структурой (модель кварков) и размерами Rр ≈ 10- 15 . Протон довольно стабилен:
составляет 10- 21!). Факт строгой квантованности электрического заряда - одна из великих загадок Природы. Протон является составной частицей, обладающей структурой (модель кварков) и размерами Rр ≈ 10- 15 . Протон довольно стабилен: 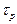 ³ 6,5 × 1031 лет.
³ 6,5 × 1031 лет.
Нейтрон, n - история его открытия (1919-1932 гг) связана с именами Э.Резерфорда, Ирен и Фредерика Жолио-Кюри; Дж Чедвика. Нейтрон не имеет электрического заряда: qn =0; точнее /qn/< 10- 21е. Значения массы: mn»1838,7me» 1,68×10- 27кг» 939,6 МэВ. Масса n» массе p. Нейтрон является составной частицей: в отличие от протона, свободный нейтрон нестабилен и распадается по схеме: 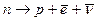 ;
; 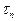 = 925с» 15 мин.
= 925с» 15 мин.
Фотоны, g, не входят в состав атома, а рождаются и уничтожаются непосредственно в процессе электронных переходов. Кванты долгое время не признавались частицами, т.к. они обладают волновыми свойствами, делокализованы в пространстве, легко рождаются и уничтожаются. Потом выяснилось, что все эти свойства присущи частицам, прежде всего электронам.
Данное атомное ядро, состоящее из Z протонов и А-Z нейтронов (всего А нуклонов) обозначают: 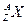 . Так как символ элемента однозначно определяет его положение в Периодической системе, Z часто опускают:
. Так как символ элемента однозначно определяет его положение в Периодической системе, Z часто опускают: 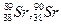 или 89,90Sr, или Sr-89, 90.
или 89,90Sr, или Sr-89, 90.
Совокупность ядер (атомов), идентичных по своему составу, т.е. с одинаковыми Z и А, называют нуклидом. Различные нуклиды с одним и тем же Z и разными А называют изотопами. Таким образом, изотопы отличаются только количеством нейтронов в ядре, вследствие чего отличаются их массовые числа: 125 I; 129 I; 131 I (протонов - 53, нейтронов -72; 76 и 78 соответственно). Существованием нейтронов объясняется тот факт, что атомная масса большинства элементов отличаются от целых чисел: у природного хлора М» 35,5, т.к. он состоит из 76% 35Сl и 24% 37Сl. Химические, микроскопические, биологические свойства изотопов практически тождественны. По ядерным свойствам изотопы отличаются очень резко.
Различные нуклиды, обладающие одним и тем же массовым числом А, называют изобарами. Их ядра содержат одинаковое количество нуклонов, но разное число протонов, разное нейтронов. Например: 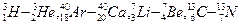 .
.
В настоящее время известно около 2000 нуклидов различных элементов, ожидается, что в будущем их число возрастет до 4000 - 5000.
 2014-02-10
2014-02-10 1577
1577







