Особенности генеза потенциала действия в кардиомиоцитах
КАРДИОМИОЦИТА
МЕХАНИЗМ ГЕНЕРАЦИИ ПОТЕНЦИАЛА ДЕЙСТВИЯ
Потенциал действия мышечной клетки миокарда – кардиомиоцита значительно отличается от потенциала действия нервного волокна и клетки скелетной мышцы. И здесь необходимо отметить следующее (рис 9), что первая фаза деполяризации протекает очень быстро, так же как в аксоне нервной клетки и представляет собой реверсию мембранного потенциала от уровня покоя (примерно –90 мВ) до пика ПД (примерно 30 мВ). Продолжительность данной фазы 1-2 мс.(слайд 3)
Далее, на следующей фазе, проявляются отличие ПД кардиомиоцита от ПД других клеток. За фазой быстрой деполяризации следует фаза плато, характерная только для клеток этого типа, а только затем наступает 3 фаза – фаза реполяризации, завершением которой является восстановление потенциала покоя. Если длительность ПД аксона составляет 1 мс, клетки скелетной мышцы 2 - 3 мс, то длительность потенциала действия кардиомиоцитов желудочков сердца составляет от 200 до 400 мс. Такое длительное развитие потенциала действия клеток сократительного миокарда желудочков неслучайно, так как благодаря этому обеспечивается синхронность генеза ПД в клетках миокарда, а следовательно и синхронность сокращения в систолу т обеспечение выброса крови в сосудистое русло.
Известно, что процесс возникновения ПД связан с изменением мембранного потенциала, а также проницаемости мембраны для различных ионов и ионных потоков.
Сохранение ионного баланса в кардиомиоцитах обеспечивает K+- Na+- и Са2+-насосы, активно перекачивающие ионы Na+ и Са2+ наружу, а ионы K + - внутрь клетки. Этот процесс носит ферментативный характер, и осуществляется благодаря локализованным в сарколемме миокардиальных клеток ферментов – К+- Na+ АТФазы и Са2+ -АТФазы.
Используя специфические ингибиторы ферментов, в частности уабоин было установлено, что плотность молекул K+- Na+ насоса в мембране, а число циклов насоса оценивается 20 в секунду. Тогда на 1 см2 за одну секунду происходят 2 • 1012 циклов насосов. Так как за каждый цикл насос переносит 3 иона Na+, то всего переносится 6 • 1012 ионов за 1 с на 1 см2.
В покое проницаемость мембраны для ионов Na+ и Са2+ весьма мала. Потенциал покоя, как и в нервных волокнах, определяется в основном К+ - потенциалом, который поддерживается благодаря работе электрогенного натриевого насоса.
Фаза деполяризации (1 фаза), не отличается по своим молекулярным механизмам от аналогичной фазы в нервных клетках, и связана со значительным повышением проводимости для натрия (слайд 4).
Но данный процесс недолгий. время жизни 1 - 2 мс и может доходить до 6 мс. Соотношение проницаемости для К+ и Na+ d ‘njn gthbjl: Р = 1:. Порог активации натриевых каналов примерно -60 мВ.
Далее процесс быстрой деполяризации мембраны сменяется более медленными фазами. Начальный входящий натриевый, ток очень быстро инактивируется, что также напоминает нервную клетку. Процесс же реполяризации носит иной молекулярный характер по сравнению с нервной клеткой.
К числу таких механизмов относятся:
1. медленный рост проводимости для Ca2+, результатом этого процесса является возникновение деполяризующего входящего тока кальция (медленный входящий ток)
2. снижение проводимости для K+ возникающее при деполяризации и уменьшающее реполязирующий выхрдящий ток K+.
Так в фазе плато, где спад мембранного потенциала происходит от +30мВ до 0 мВ работают два типа каналов – медленные кальциевые и калиевые каналы. Кальциевые каналы имеют порог активации около -30 мВ, а время их жизни примерно 200 мс. В результате открывания кальциевых каналов возникает деполяризующий медленный входящий в клетку кальциевый ток.
Одновременно с ростом кальциевого тока растет проводимость для ионов калия gК, что приводит к возникновению вытекающего калиевого тока, реполяризующего мембрану. Далее происходит уменьшение проводимости мембраны для ионов кальция при продолжающемся увеличении проводимости для ионов калия и насиупает следующая фаза - фаза — реполяризация
Она характеризуется закрытием кальциевых каналов, ростом величины gК и усилением выходящего тока К+
Основываясь на существование трех типов каналов в кардиомиоците можно получить уравнение для мембранного тока при возбуждении
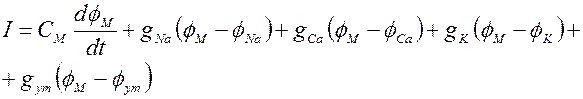
Второе и третье слагаемое - составляющие входящих деполяризующего быстрого тока Na+ и медленного Са2+, четвертое -выходящий реполяризующий ток K+. Для кальциевого канала, так же как и для натриевого, предполагается существование активирующих d и инактивирующих f частиц, состояние которых описывается некоторыми вероятностными потенциалозависимыми параметрами.
Описание кинетики параметров активации d и инактивации f является сложной научной задачей, поиски решения которой в настоящее время интенсивно ведутся.
Процессы возбуждения кардиомиоцита изучаются с помощью ряда специальных методов. Один из них - это метод блокаторов (антагонистов) ионов кальция. Были найдены специфические блокаторы кальциевого тока в миоците: препараты Д-600, верапамил, катионы металлов La3+, Mn2+ и некоторые другие. Эти вещества прекращают доступ кальция внутрь клетки и тем самым изменяют и величину, и форму потенциала действия. Кальциевые каналы не блокируются тетродотоксином (блокатором ионов Na+, что дает основание допускать существование в кардиомиоцитах отдельных кальциевых каналов.
Распределение ионов кальция по сердечной мышце в норме и патологии изучается с помощью метода радионуклидной диагностики. Для этого используют радиоактивный изотоп кальция - Са2+, b - излучение которого регистрируется сканерами.
3. ДИАСТОЛИЧЕСКАЯ ДЕПОЛЯРИЗАЦИЯ И ПОРОГОВЫЙ
ПОТЕНЦАЛ
Объяснение автоматии сердца связывают с развитием микроэлектродной техники и открытия медленной диастолической деполяризации, характерной для водителей ритма (слайд 5). В нормальных условиях большинство предсердных и желудочковых клеток поддерживают стабильный мембранный потенциал в течение диастолы. В отличии от этого, волокна специализированной мускулатуры сердца (волокна синусового и атриовентрикулярного узлов, латентные пейсмекеры предсердий, волокна Пуркинье желудочков обнаруживают в период диастолы медленно нарастающую деполяризацию. Применение микроэлектродной техники для отведения мембранных потенциалов покоя и потенциала действия позволило обнаружить, что медленная диастолическая деполяризация и потенциал действия пейсмекерных волокон разных отделов сердца различаются рядом особенностей. Потенциал действия клеток синоатриального узла (слайд 6) характеризуются наиболее выраженной медленной диастолической деполяризацией, плавным переходом в фазу быстрой деполяризации (фазе 0) и медленным нарастанием кривой в эту фазу, закругленностью вершины (отсутствуют фазы ранней быстрой реполяризации-фаза 1); потенциал превышения (овершут) и фаза медленной реполяризации или плато (фаза 2) здесь слабо выражены; потенциал покоя низок. Таким образом, типичные потенциалы действия волокон синоатриального узла отличаются сглаженностью, медленным протеканием всех фаз и напоминают синусоиду.
Типичные потенциалы действия волокон предсердной части атриовентрикулярного узла также характеризуются низким уровнем потенциала покоя; медленная диастолическая деполяризация выражена здесь в разной степени, но меньше, чем в волокнах синоатриального узла, потенциал превышения также выражен слабо или отсутствует, а вершина потенциала действия закруглена так, что нет четко выраженной фазы 1. Потенциал действия волокон атриовентрикулярного узла представляет собой переходный тип: в верхней части узла потенциала действия имеет сходство с потенциалом действия клеток предсердий, а в его нижней с потенциалом действия волокон пучка Гиса
Потенциал действия клеток пучка Гисса и волокон Пуркинье характеризуется большой амплитудой, наличием потенциала превышения, резким нарастанием кривой в фазу 0 (быстрая деполяризация) выраженной фазой 1. (начальная деполяризация) и длительным плато; медленная диастолическая деполяризация (фаза 4) выражена у них в различной степени, но скорость ее всегда ниже, чем в клетках синоатриального узла (слайд 7).
Частота автоматических возбуждений того или иного водителя ритма определяется скоростью медленной диастолической деполяризации, а также разностью между уровнем трансмембранного потенциала, достигнутым в конце реполяризации (максимальным диастолическим потенциалом) и критическим потенциалом, при котором наступает регенеративная лавинообразная деполяризация.
Критическим потенциалом называют уровень мембранный потенциал, при котором возникает распространяющийся на всю клетку потенциал действия.
Пороговый потенциал характеризуется числом милливольт, на которое необходимо увеличить исходный потенциал внутренней стороны мембраны для достижения критического уровня деполяризации. Таким образом, чем больше разница между исходным и критическим потенциалом, тем выше порог и следовательно, ниже возбудимость ткани.
Величина порогового потенциала в тех или иных клетках сердца обусловлена, по-видимому, особенностями процессе обмена веществ в этих клетках, определяющего состояние поверхностной мембраны.
Чем меньше разность между максимальным диастолическим и критическим потенциалами (другими словами, чем меньше порог возбуждения) и чем выше скорость медленной диастолической деполяризации, тем больше частота спонтанных возбуждений (слайд 8).
Она наиболее высока в волокнах синусового узла и обычно составляет в норме у человека 70 возбуждений в мин. Частота автоматических возбуждений водителей ритма атриовентрикулярного узла и волокон Пуркинье значительно ниже и составляет у человека соответственно менее 40 и около 30 возбуждений в мин. (Атриовентрикулярной и идиовентрикулярные ритмы).
Истинными водителями ритма называют клетки синоатриального узла, медленная диастолическая деполяризация которых снижает мембранный потенциал до критического уровня и приводит к возникновению спонтанного возбуждения. Остальные волокна проводящей системы сердца (некоторые клетки предсердий, клетки атриовентрикулярного узла и пучка Гиса, волокна Пуркинье) получили название латентных, или потенциальных, водителей ритма, так как при нормальной их связи с деятельным синусным узлом потенциал действия в этих клетках возникает в результате возбуждения, приходящего из синоатриального узла. Происходит это вследствие того, что скорость диастолической деполяризации в «латентных» водителях ритма медленнее, чем в синусном узле. Основным электрофизиологическим отличием истинных водителей ритма от латентных, или потенциальных, является плавность перехода медленной диастолической деполяризации в фазу 0 потенциала действия клеток — истинных водителей и резкий переход медленной диастолической деполяризации в фазу 0 потенциала действия клеток — потенциальных водителей ритма.
В нормальных условиях как пейсмекер функционирует только синоатриальный узел. Автоматия других образований проводящей системы выявляется только при прекращении доступа возбуждений из сино-атриального узла к этим центрам автоматии второго порядка.
1. Антонов В.Ф., Черныш А.М., В.И. Пасечник и др. Биофизика. М., Владос, 2000
2. Владимиров Ю.А. с соавт. Биофизика. М., Медицина, 1983.
3. Рубин А.Е. Биофизика: Биофизика клеточных процессов 2- том. – М. Книжный дом “Университет”, 2000 – 468 с
4. Альбертс Б., Брей Д., Льютс Дж. и др. Молекулярная биология клетки. – М.:Мир, 1994. – Т.1-3.
5. Медицинская биофизика, ред. Самойлов В.О., Л., 2004 478c.
6. Эллиот В., Эллиот Д. Биохимия и молекулярная биология. – М.: НИИ Биомедицинской химии РАМН, 1999.
 2014-02-12
2014-02-12 5703
5703