ЛЕКЦИЯ №2
N2+3H2↔2NH3 (а)
CH4↔C+2H2 (б)
CO+H2Oг↔H2+CO2 (в)
CO+H2Oг↔H2+CO2 (а)

На выходе из реактора в газовой смеси содержится продукт реакции и непрореагировавшие исходные реагенты А и В. Газовая смесь поступает в конденсатор 2, где она охлаждается. При этом










 А,B,R
А,B,R
 2
2
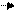




 A,B,R,SA,B,R,S
A,B,R,SA,B,R,S
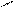
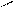

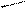
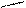
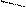
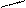
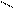 А + В 4 5 и т.д.
А + В 4 5 и т.д.


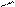

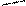


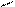
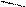


 A+B
A+B

 1 A,B,S A,B,S
1 A,B,S A,B,S
 А,В R 1 R 2 R 3
А,В R 1 R 2 R 3
Рис.2. Циркуляционная схема Рис.3. Схема химико-технологического
химико-технологического про- процесса с выводом продукта реакции R:
цесса с выводом продукта реакции: 1-3- реакторы; 4,5-конденсаторы.
1-реактор; 2-конденсатор.
продукт реакции R конденсируется и выводится из системы, а исходные реагенты А и В возвращаются в процесс. В качестве примера осуществления такой схемы можно привести процесс синтеза аммиака из N2 и H2 на катализаторе:
N2+3H2↔2NH3+Q

 При проведении реакции с образованием
При проведении реакции с образованием 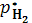
двух продуктов, например по модельной реак-
ции (2)
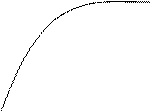
р Н2О

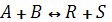 Рис.4. Зависимость рав-
Рис.4. Зависимость рав-
новесного давления p*Н2 от парциального давления паров воды pH2Oдля реакции С0+Н20↔Н2 + С02.
Процесс ведут по схеме, изображенной на рисунке 3. Cхема проста и не требует особых пояснений.
Скорость химической реакции выражается уравнением Аррениуса:
r=dC/dτ=kCn (11)
где n – порядок реакции.
Но константа скорости реакции k выражается уравнением Аррениуса
k=k0e-E/RT (12)
где k0 – предэкспоненциальный множитель
E – энергия активации.
Подставим значение k из уравнения (12) в уравнение (11) находим
r=k0e-E/RTCn (13)
 2014-02-12
2014-02-12 261
261







