1. Для процесса: Эо + 2Н+ = Э+ + 2Но (1)
2.
|
2. Как сместить равновесие (1) вправо?
а) Заменить окислитель Н+ на анион кислоты-окислителя
Ag + 2HNO3. конц = AgNO3 + NO2 + H2O;
2Ag + 2H2SO4, конц = Ag2SO4 + SO2 + 2H2O;
Cu + 4HNO3, конц = Cu(NO3)2 + 2NO2 + 2H2O;
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O;
«царская водка»
б) Окислить Но кислородом
2Cu + 4CH3COOH + O2 = 2Cu(CH3COO)2 + 2H2O
в) Убрать ионы Э+ в осадок
2Э + 2НГ = 2ЭГ¯ + Н2 (Г = Cl-, Br-, I-, CN-).
г) Связать ионы Э+ в прочный комплекс
2Э + 4НГ = 2Н[ЭГ2] + Н2
I 2Cu + 6KCN + 2H2O = 2K2 [Cu(CN)3] + 2KOH + H2 (только Cu)
II 4Э + 8 KCN + 2H2O + O2 = 4K[Э(CN)2] + 4KOH (Э=Ag, Au).
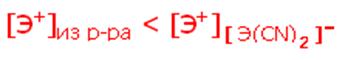 Комплекс [Э(CN)2]- образуется, так как
Комплекс [Э(CN)2]- образуется, так как
Реакции I и II для разделения Cu, Au, Ag.
Получение Эмет
2К[Э(CN)2] + Zn = Na2[Zn(CN)4] + 2Э¯
 2014-02-09
2014-02-09 264
264

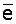 = Эо
= Эо







