Существует несколько формулировок III начала термодинамики, которые, строго говоря, не эквивалентны:
1) При абсолютном нуле температуры энтропия абсолютно твердого кристаллического вещества равна нулю (постулат Планка );
2) Абсолютный нуль температуры недостижим (принцип недостижимости абсолютного нуля температуры);
3) По мере приближения температуры к абсолютному нулю значения энтальпии 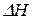 и энергии Гиббса
и энергии Гиббса 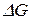 сближаются (тепловая теорема Нернста).
сближаются (тепловая теорема Нернста).
Третий закон термодинамики позволяет рассчитать абсолютные значение энтропии веществ. Ранее с учетом постулата Планка получено уравнение:
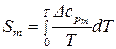 . (86)
. (86)
По мере приближения к абсолютному нулю, когда 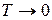 , теплоемкость становится бесконечно малой величиной и стремится к нулю
, теплоемкость становится бесконечно малой величиной и стремится к нулю 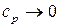 . Из анализа уравнения (86) видно, что при
. Из анализа уравнения (86) видно, что при 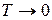 подынтегральное выражение в результате деления двух бесконечно малых величин становиться неопределенным, а само уравнение теряет смысл. Это означает, что невозможно снизить температуру до абсолютного нуля (принцип недостижимости абсолютного нуля температуры). В настоящее время максимально достигнутая температура порядка
подынтегральное выражение в результате деления двух бесконечно малых величин становиться неопределенным, а само уравнение теряет смысл. Это означает, что невозможно снизить температуру до абсолютного нуля (принцип недостижимости абсолютного нуля температуры). В настоящее время максимально достигнутая температура порядка 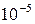
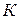 .
.
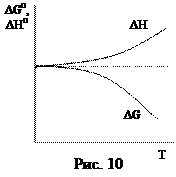 Согласно тепловой теореме Нернста при приближении температуры к абсолютному нулю кривые изменения энергии Гиббса
Согласно тепловой теореме Нернста при приближении температуры к абсолютному нулю кривые изменения энергии Гиббса 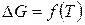 и теплового эффекта (энтальпии)
и теплового эффекта (энтальпии) 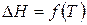 соединяются в общей точке и имеют общую касательную, параллельную оси температур (рис. 10).
соединяются в общей точке и имеют общую касательную, параллельную оси температур (рис. 10).
Из уравнения Гиббса–Гельмгольца (84) имеем:
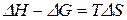 .
.
Таким образом, вблизи абсолютного нуля температур 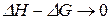 :
:
Практическое значение III начала термодинамики не исчерпывается возможностью определения абсолютной энтропии веществ. На его основе возможен расчет химических равновесий (в частности констант равновесия), без измерения параметров (концентрации или давления), определение всех термодинамических функций состояния для физико-химических процессов, в том числе и фазовых переходов.
 2014-02-12
2014-02-12 4862
4862






