| Критерий оценки | Ограничения | Условие равновесия | Условие протекания самопроизвольного процесса |
| Энтропия S | Изолированная система | Δ S = 0, S = S max | Δ S > 0 |
| Изобарно-изотермический потенциал G | р,Т = const | Δ G = 0, G = G min | Δ G < 0 |
| Изохорно-изотермический потенциал F | V, Т = const | Δ F = 0, F = F min | Δ F < 0 |
Изменение соответствующего термодинамического потенциала в ходе какого-либо процесса, протекающего при температуре Т, вычисляют по уравнению Гиббса-Гельмгольца:
– для изобарно-изотермического процесса
|
– для изохорно-изотермического процесса
|
D H иD U – изменение полной энергии в системе при р = const и V = const соответственно; D G иD F – энергия, которая связана с производством полезной работы; T D S – энергия, которая перешла в энергию хаотичного (теплового) движения частиц, вследствие чего она уже не может перейти в работу. Поэтому D G иD F называют еще свободной энергией, а T D S – связанной энергией.
Легко установить связь между D G и D F. Вычитая из уравнения (9) уравнение (10), и учитывая, что D U = D Н – D nRT, получим:

Термодинамические потенциалы могут играть роль характеристических функций. Это значит, что с помощью их производных можно выразить свойства системы, необходимые для ее характеристики.
Например, изобарно-изотермический потенциал является функцией двух параметров – давления и температуры, т.е.
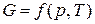 .
.
Запишем dG в виде суммы частных производных
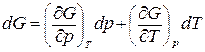 .
.
Учитывая, что
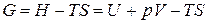 ,
,
получаем:
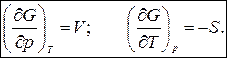
 2014-02-12
2014-02-12 1450
1450







