Третье начало термодинамики
С понижением температуры во всякой системе наблюдается тенденция к упорядоченности. Если бы тело можно было охладить до температуры, равной абсолютному нулю, когда тепловые движения молекул не мешали бы установлению порядка, то в системе установился бы идеальный порядок, которому соответствовала бы минимальная энтропия.
Если при абсолютном нуле температуры над системой совершить работу, то энтропия системы не изменится. Это доказано и отражено в теореме Нернста [2]:
при абсолютном нуле температуры любые изменения состояния происходят без изменения энтропии.
При Т=0 энтропия минимальна S=0. Иногда теорему Нернста возводят в ранг третьего начала термодинамики.
Часто третье начало термодинамики формулируют так: абсолютный нуль температуры недостижим.
Действительно, если бы существовало тело с Т=0 К (следовательно, S=0), то можно было бы построить вечный двигатель второго рода, что противоречит второму началу термодинамики.
Часть энергии системы, которая при данных условиях может быть преобразована в механическую работу, называют свободной энергией. Обычно свободную энергию обозначают буквой F. Понятие свободной энергии было введено Гельмгольцем в 1882 году, поэтому свободную энергию иногда называют функцией Гельмгольца [2].
Система не может совершить работу, превышающую её свободную энергию. Наивыгоднейшим образом можно совершить работу, используя изотермический процесс. Поэтому можно уточнить понятие свободной энергии. Свободная энергия системы может быть измерена работой при изотермическом процессе, переводящем систему из некоторого начального состояния в состояние, при котором свободная энергия равна нулю. Для записи свободной энергии используем основное термодинамическое тождество:
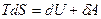 . Отсюда выразим элементарную работу:
. Отсюда выразим элементарную работу: 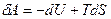 . Если учтём, что T= const, то работа становится полным дифференциалом от (U-TS):
. Если учтём, что T= const, то работа становится полным дифференциалом от (U-TS):
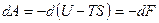 .
.
Здесь F=U-TS - свободная энергия, выраженная через внутреннюю энергию, температуру и энтропию системы. Свободная энергия является функцией состояния, также как и внутренняя энергия системы. Отсюда видно, что, чем выше энтропия системы, тем меньше внутренняя энергия, доступная для преобразования в механическую работу. При условии ТS=U свободная энергия равна нулю, следовательно, и работа равна нулю.
Если система изотермически расширяется, совершая положительную работу, то свободная энергия уменьшается. При изотермическом сжатии, когда работа самой системы отрицательна, свободная энергия увеличивается.
Внутренняя энергия идеального газа не зависит от занимаемого им объёма, следовательно, 1 моль газа, сжатого в баллоне, имеет такую же внутреннюю энергию, что и несжатый газ при той же температуре. Но сжатый газ имеет большую свободную энергию, потому, что при изотермическом расширении он может совершить большую работу.
Если процесс изотермического расширения газа протекает необратимо, то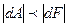 . Обобщая обратимые и необратимые процессы, можно записать:
. Обобщая обратимые и необратимые процессы, можно записать: 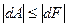 . Возможен случай, когда изменение свободной энергии вообще не сопровождается совершением механической работы – расширение газа в пустоту.
. Возможен случай, когда изменение свободной энергии вообще не сопровождается совершением механической работы – расширение газа в пустоту.
 2014-02-13
2014-02-13 668
668








