По определению, энтропия
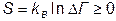 . (VI.3.1)
. (VI.3.1)
Для любых квантовых систем существует наинизшее по энергии (основное) состояние. Если плотность системы остается конечной, то при стремлении энергии к основному значению энтропия стремится к постоянному значению, 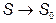 , ни от объема
, ни от объема 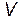 , т.е. от размеров системы, ни от каких-либо других внешних параметров;
, т.е. от размеров системы, ни от каких-либо других внешних параметров; 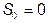 только если
только если 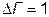 . В реальных системах
. В реальных системах 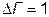 не всегда. Когда происходит «замораживание» системы, т.е. процессы релаксации сильно замедляются,
не всегда. Когда происходит «замораживание» системы, т.е. процессы релаксации сильно замедляются, 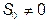 (примером может быть стекло). Таким образом, при
(примером может быть стекло). Таким образом, при 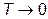 энтропия
энтропия 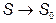 , т.е. постоянному значению, не зависящему от внешних воздействий на систему.
, т.е. постоянному значению, не зависящему от внешних воздействий на систему.
Рассмотрим, как ведет себя при этом теплоемкость. Пусть сначала внешним параметром является объем. Тогда согласно (V.2.6) и (V.2.10)
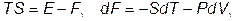 (VI.3.2)
(VI.3.2)
так что
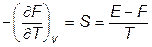 (VI.3.3)
(VI.3.3)
При 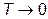 энтропия
энтропия 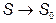 , поэтому
, поэтому 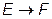 . Из (VI.3.3) по правилу Лопиталя получаем
. Из (VI.3.3) по правилу Лопиталя получаем
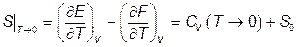 .
.
отсюда следует, что
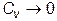 при
при 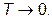 (VI.3.4)
(VI.3.4)
Если же внешним параметром служит давление, то вместо (VI.3.2) используем соотношение
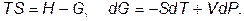 (VI.3.5)
(VI.3.5)
Аналогично предыдущему имеем при 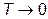
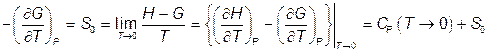
Поэтому
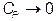 при
при 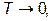 (VI.3.6)
(VI.3.6)
т.е. теплоемкость тела стремится к нулю при стремлении абсолютной температуры к нулю.
Таким образом, при 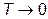 остужать тело, т.е. отнимать у него тепло становится все труднее и труднее, поскольку
остужать тело, т.е. отнимать у него тепло становится все труднее и труднее, поскольку 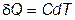 , а теплоемкость
, а теплоемкость 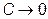 вне зависимости от внешних условий.
вне зависимости от внешних условий.
Поэтому можно сформулировать вывод, что абсолютный нуль температуры недостижим. Это утверждение составляет содержание теоремы Нернста, или Третьего начала термодинамики.
Итак, сформулируем четыре Начала термодинамики.
«Нулевое» начало.
0. Температура одинакова по всей системе, находящейся в термодинамическом равновесии.
 2014-02-13
2014-02-13 539
539







