| Номер титрования | V (FeSO4) Объем соли железа | V (KMnO4) Объем перманганата калия | V ср (KMnO4) Средний объем перманганата калия |
Требования к результатам опыта
1. Рассчитать молярную концентрацию эквивалентов раствора соли железа по закону эквивалентов:
с эк (FeSO4) · V (FeSO4) = с эк (KMnO4) · V (KMnO4),
откуда 




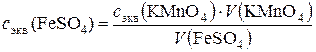
 ,
,
где с эк (FeSO4) и с эк (KMnO4) – молярные концентрации эквивалентов растворов; V (FeSO4) и V (KMnO4) − объемы реагирующих растворов.
2. Рассчитать, какому количеству металлического железа соответствует содержание FeSO4 в объеме исследуемого раствора по формуле
m (Fe) = M эк (Fe) · с эк (FeSO4),
где M эк (Fe) – молярная масса эквивалентов железа.
3. Рассчитать титр раствора FeSO4 по формуле
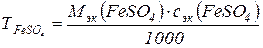 , г/мл,
, г/мл,
где М эк (FeSO4) – молярная масса эквивалентов FeSO4; с эк (FeSO4) – молярная концентрация эквивалентов FeSO4.
 2014-09-04
2014-09-04 663
663








