Химически необратимые реакции при данных условиях идут практически до конца, до полного расхода одного из реагирующих веществ (NH4NO3 → 2H2O + N2O –никакая попытка получить нитрат из Н2О и N2O не приводит к положительному результату).
Химически обратимые реакции протекают одновременно при данных условиях как в прямом, так и в обратном направлении. Необратимых реакций меньше, чем обратимых. Примером обратимой реакции служит взаимодействие водорода с иодом.
Через некоторое время скорость образования HI станет равной скорости его разложения.
Иными словами, наступит химическое равновесие.
Химическим равновесием называется состояние системы, при котором скорость образования продуктов реакции равна скорости их превращения в исходные реагенты.
Химическое равновесие является динамическим, то есть его установление не означает прекращения реакции.
Масса веществ, вступивших в реакцию, равна массе всех продуктов реакции.
Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
|
|
|
Признаки истинного химического равновесия:
1. состояние системы остается неизменным во времени при отсутствии внешних воздействий;
2. состояние системы изменяется под влиянием внешних воздействий, сколь малы бы они ни были;
3. состояние системы не зависит от того, с какой стороны она подходит к равновесию.
При установившемся равновесии произведение концентраций продуктов реакции, деленное на произведение концентраций исходных веществ, в степенях, равных соответствующим стехиометрическим коэффициентам, для данной реакции при данной температуре представляет собой постоянную величину, называемую константой равновесия.
Концентрации реагентов при установившемся равновесии называются равновесными концентрациями.
В случае гетерогенных обратимых реакций в выражение Кс входят только равновесные концентрации газообразных и растворенных веществ. Так, для реакции СаСО3 ↔ СаО + СО2
Кс=[СО2].
При неизменных внешних условиях положение равновесия сохраняется сколь угодно долго. При изменении внешних условий положение равновесия может измениться. Изменение температуры, концентрации реагентов (давления для газообразных веществ) приводит к нарушению равенств скоростей прямой и обратной реакций и, соответственно, к нарушению равновесия. Через некоторое время равенство скоростей восстановится. Но равновесные концентрации реагентов в новых условиях будут уже другими. Переход системы из одного равновесного состояния к другому называется смещением или сдвигом равновесия. Химическое равновесие можно сравнить с положением коромысла весов. Подобно тому, как оно изменяется от давления груза на одну из чашек, химическое равновесие может смещаться в сторону прямой или обратной реакции в зависимости от условий процесса. Каждый раз при этом устанавливается новое равновесие, соответствующее новым условиям.
|
|
|
Численное значение константы обычно изменяется с изменением температуры. При постоянной температуре значения Кс не зависят ни от давления, ни от объема, ни от концентраций веществ.
Зная численное значение Кс, можно вычислить значения равновесных концентраций или давлений каждого из участников реакции.
Направление смещения положения химического равновесия в результате изменения внешних условий определяется принципом Ле Шателье:
если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
Растворение как физико-химический процесс. Сольватация. Сольваты. Особые свойства воды как растворителя. Гидраты. Кристаллогидраты. Растворимость веществ. Растворение твердых, жидких и газообразных веществ. Влияние температуры, давления и природы веществ на растворимость. Способы выражения состава растворов: массовая до-ля, молярная концентрация, эквивалентная концентрация и мольная доля.
Известны две основные теории растворов: физическая и химическая.
Физическая теория растворов была предложена лауреатами Нобелевской премии голландцем Я. Вант-Гоффом (1885 г.) и шведским физико-химиком С. Аррениусом (1883 г.). Растворитель рассматривается как химически инертная среда, в которой равномерно распределены частицы (молекулы, ионы) растворенного вещества. Предполагается отсутствие межмолекулярного взаимодействия, как между частицами растворенного вещества, так и между молекулами растворителя и частицами растворенного вещества. Частицы растворителя и растворенного вещества равномерно распределяются в объеме раствора вследствие диффузии. Впоследствии выяснилось, что физическая теория удовлетворительно описывает природу лишь малой группы растворов, так называемых идеальных растворов, в которых частицы растворителя и растворенного вещества действительно не взаимодействуют между собой. Примерами идеальных растворов являются многие газовые растворы.
Химическая (или сольватная) теория растворов предложена Д.И. Менделеевым (1887 г.). Он впервые на огромном экспериментальном материале показал, что между частицами растворенного вещества и молекулами растворителя происходит химическое взаимодействие, в результате которого образуются нестойкие соединения переменного состава, называемые сольватамиили гидратами( если растворителем является вода). Д.И. Менделеев определил раствор как химическую систему, все формы взаимодействия в которой связаны с химической природой растворителя и растворяемых веществ. Главную роль в образовании сольватов играют непрочные межмолекулярные силы и водородная связь.
Процесс растворения нельзя представить простой физической моделью, например, статистическим распределением растворенного вещества в растворителе в результате диффузии. Обычно он сопровождается заметным тепловым эффектом и изменением объема раствора, за счет разрушения структуры растворяемого вещества и взаимодействия частиц растворителя с частицами растворенного вещества. Оба эти процесса сопровождаются энергетическими эффектами. Для разрушения структуры растворяемого вещества требуется затрата энергии, тогда как при взаимодействии частиц растворителя и растворенного вещества происходит выделение энергии. В зависимости от соотношения этих эффектов процесс растворения может быть эндотермическим или экзотермическим.
|
|
|
При растворении сульфата меди присутствие гидратов легко обнаружить по изменению цвета: безводная соль белого цвета, растворяясь в воде, образует раствор синего цвета. Иногда гидратная вода прочно связывается с растворенным веществом и при выделении его из раствора входит в состав его кристаллов. Кристаллические вещества, содержащие воду, называются кристаллогидратами, а вода, входящая в структуру таких кристаллов, называется кристаллизационной. Состав кристаллогидратов определяет формула вещества, в которой указано число молекул кристаллизационной воды, приходящееся на одну его молекулу. Так, формула кристаллогидрата сульфата меди (медного купороса) CuSO4×5H2O. Сохранение кристаллогидратами окраски, характерной для соответствующих растворов, служит прямым доказательством существования в растворах аналогичных гидратных комплексов. Цвет кристаллогидрата зависит от числа молекул кристаллизационной воды.
Существуют различные способы выражения состава раствора. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
В общем виде концентрация может быть выражена как число частиц в единице объема или как отношение числа частиц данного вида к общему количеству частиц в растворе. Количество растворенного вещества и растворителя измеряют в единицах массы, объема или в молях. В целом, концентрация раствора – это количество растворенного вещества в конденсированной системе (смеси, сплаве или в определенном объеме раствора). Известны разные способы выражения концентрации растворов, каждый из которых имеет преимущественное применение в той или иной области науки и техники. Обычно состав растворов выражают с помощью безразмерных (массовая и мольная доли) и размерных величин (молярная концентрация вещества, молярная концентрация вещества – эквивалента и моляльность).
Массовая доля – величина, равная отношению массы растворенного вещества (m1) к общей массе раствора (m):
|
|
|
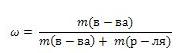
 2015-01-30
2015-01-30 7457
7457
