В органической химии используются две теории кислот и оснований:
· теория Брёнстеда-Лоури;
· теория Льюиса.
Кислоты и основания по Брёнстеду-Лоури
В основе теории - перенос протона (Н+). Согласно Бренстеду-Лоури кислоты – вещества, способные выступать в качестве донора протона (т.е. его отдавать); основания – вещества, способные быть акцепторами протона (т.е. его присоединять).
Уравнение кислотно-основного взаимодействия по Брёнстеду-Лоури:

Для проявления кислотных свойств органических соединений связь водород-элемент должна быть полярной или поляризованной. Многие вещества содержат связи О-Н, N-H, S-H. В ряде случаев кислотные свойства могут проявлять и С-Н фрагменты. В зависимости от элемента, отдающего протон, органические кислоты классифицируют на ОН-, SH-, NH- и СН-кислоты. Кислотные свойства могут проявлять нейтральные молекулы или катионы.
Основания же должны иметь или неподеленную пару электронов у атома, присоединяющего протон, или отрицательный заряд. В некоторых случаях основные свойства могут проявлять соединения с p-связями.
|
|
|
Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты с сопряженным основанием (напр., СН3СООН и CH3COONa — ацетатный буфер) или слабого основания и сопряженной кислоты (напр., NH3 и NH4CI — аммиачный буфер).[1] Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических и биохимических процессах.
Буферные растворы имеют большое значение для протекания реакций в живых организмах. Например, в крови постоянство водородного показателя рН (химический гомеостаз) поддерживается тремя независимыми буферными системами: бикарбонатной, фосфатной и белковой. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.). Значение pH буферного раствора можно рассчитать по формуле:
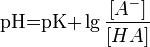 , где это отрицательный десятичный логарифм от константы диссоциации кислоты.
, где это отрицательный десятичный логарифм от константы диссоциации кислоты.
По сути:
Гидролиз солей. Гидролиз солей по катиону и аниону. Механизм гидролиза. Молекулярные и ионные уравнения реакций гидролиза. Четыре типа солей в зависимости от гидролизуемости составляющих их ионов. Влияние природы, заряда, радиуса ионов на гидролизуемость. Степень гидролиза. Константа гидролиза.
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
Соли – это ионные соединения, при попадании в воду они диссоциируют на ионы. В водном растворе эти ионы ГИДРАТИРОВАНЫ – окружены молекулами воды.
|
|
|
Обнаружено, что водные растворы многих солей имеют не нейтральную среду, а либо слабокислую, либо щелочную. Объяснение этого – взаимодействие ионов соли с водой. Этот процесс называется ГИДРОЛИЗОМ.
По отношению к воде соли можно разделить на 4 группы:
1) Соль, образованная сильным основанием и сильной кислотой - НЕ ГИДРОЛИЗУЕТСЯ, в растворе только диссоциирует на ионы. Среда нейтральная.
ПРИМЕР: Не гидролизуются соли - NaCl, KNO3, RbBr, Cs2SO4, KClO3, и т. п. В растворе эти соли только диссоциируют: Cs2SO4 à 2Cs++SO42-
2) Соль, образованная сильным основанием и слабой кислотой - гидролиз ПО АНИОНУ. Анион слабой кислоты отрывает от воды ионы водорода, связывает их. В растворе образуется избыток ионов ОН - - среда щелочная.
ПРИМЕР: Гидролизу по аниону подвергаются соли - Na2S, KF, K3PO4, Na2CO3, Cs2SO3, KCN, KClO, и кислые соли этих кислот.
K3PO4 – соль, образованная слабой кислотой и сильным основанием. Гидролизуется фосфат-анион.
PO43- + НОН ⇄ НРО42-+ОН-
K3PO4 + Н2О ⇄ К2НРО4 + КОН
(это первая ступень гидролиза, остальные 2 идут в очень малой степени)
3) Соль, образованная слабым основанием и сильной кислотой- гидролиз ПО КАТИОНУ. Катион слабого основания отрывает от воды ион ОН-, связывает его. В растворе остаётся избыток ионов H+ - среда кислая.
ПРИМЕР: Гидролизу по катиону подвергаются соли - CuCl2, NH4Cl, Al(NO4)3, Cr2(SO4)3.
CuSO4 – соль, образованная слабым основанием и сильной кислотой. Гидролизуется катион меди: Cu+2 + НОН ⇄ CuOH+ +H+
2CuSO4+2H2O ⇄ (CuOH)2SO4 + H2SO4
4) Соль, образованная слабым основанием и слабой кислотой - гидролиз И ПО КАТИОНУ И ПО АНИОНУ.
Если какие-либо из продуктов выделяются в виде осадка или газа, то гидролиз необратимый, если оба продукта гидролиза остаются в растворе - гидролиз обратимый.
ПРИМЕР: Гидролизуются соли – Al2S3,Cr2S3(необратимо): Al2S3 + H2O à Al(OH)3¯ + H2S
NH4F, CH3COONH4(обратимо) NH4F + H2O ⇄NH4OH + HF
а) Молекулярное уравнение:
Cu(NO3)2 + HOH ⇄ CuOHNO3 + HNO3
Полное ионное уравнение:
Cu2+ + 2NO3- + HOH ⇄ CuOH+ + NO3- + H+ + NO3-
Сокращенное ионное уравнение:
Cu2+ + HOH ⇄ CuOH+ + H+
б) Молекулярное уравнение:
2CrCl3 + 3Cs2SiO3 + 6H2O → 2Cr(OH)3 + 3H2SiO3 + 6CsCl
Полное ионное уравнение:
2Cr3+ + 6Cl- + 6Cs+ + 3SiO32- + 6HOH → 2Cr(OH)3 + 3H2SiO3 + 6Cs+ + 6Cl-
Сокращенное ионное уравнение:
2Cr3+ + 3SiO32- + 6HOH → 2Cr(OH)3 + 3H2SiO3
Количественными оценками способности соли подвергаться гидролизу являются степень гидролиза άгид и константа гидролиза Кгид. Степень гидролиза показывает, какая часть соли, содержащаяся в растворе (СМ), подверглась гидролизу (СМгид) и рассчитывается как отношение:
άгид = СМ гид / СМ (100%).
Очевидно, что для обратимого процесса гидролиза άгид < 1 (<100%), а для необратимого гидролиза άгид = 1 (100%). Степень гидролиза зависит от концентрации соли, температуры раствора άгид увеличивается при разбавлении раствора соли и при увеличении температуры раствора: если СМ ↓, то άгид ↑, если Т↑, то άгид ↑.
Константа гидролиза есть константа равновесия процесса гидролиза, и по своему физическому смыслу определяет степень необратимости гидролиза. Чем больше Кгид, тем необратимее гидролиз. Кгид имеет свое выражение для каждого случая гидролиза.
Соль образована сильным основанием и слабой кислотой (на примере NaCNS).
Сокращенное уравнение гидролиза: CNS- + HOH <=> HCNS + OH-
Крав = Кгид = [HCNS] [OH-] * [H+]
[CNS-] [HOH] * [H+]
В этом выражении для Крав числитель и знаменатель дроби умножили на [H+]. Очевидно, что выражение для Кгид принимает вид: Кгид = К-w / Кдис (HCNS). Поскольку К-w величина постоянная и равна 10-14, очевидно, что чем меньше Кдис слабой кислоты, анион которой входит в состав соли, тем больше Кгид.
 2015-01-30
2015-01-30 2633
2633








