Неисчерпаемым источником кислорода являтся воздух. Чтобы получить из него кислород, следует отделить этот газ от азота и других газов. На такой идее основан промышленный метод получения кислорода. Его реализуют, используя специальную, достаточно громоздкую аппаратуру. Сначала воздух сильно охлаждают до превращения его в жидкость. Затем температуру сжиженного воздуха постепенно повышают. Первым из него начинает выделяться газ азот (температура кипения жидкого азота составляет —196 °С), а жидкость обогащается кислородом.
Получение кислорода в лаборатории. Лабораторные методы получения кислорода основаны на химических реакциях.
Дж. Пристли получал этот газ из соединения, название которого — меркурий(II) оксид. Ученый использовал стеклянную линзу, с помощью которой фокусировал на веществе солнечный свет.
В современном исполнении этот опыт изображен на рисунке 54. При нагревании меркурий(||) оксид (порошок желтого цвета) превращается в ртуть и кислород. Ртуть выделяется в газообразном состоянии и конденсируется на стенках пробирки в виде серебристых капель. Кислород собирается над водой во второй пробирке.
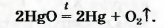
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.
Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:
• калий перманганат KMnO4 (бытовое название марганцовка; вещество является распространенным дезинфицирующим средством)
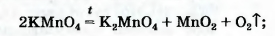
• калий хлорат KClO3 (тривиальное название — бертолетова соль, в честь французского химика конца XVIII — начала XIX в. К.-Л. Бертолле)
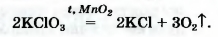
Небольшое количество катализатора — манган (IV) оксида MnO2 — добавляют к калий хлорату для того, чтобы разложение соединения происходило с выделением кислорода1.
Строение молекул гидридов халькогенов Н2Э можно проанализировать с помощью метода молекулярных орбиталей (МО). В качестве примера рассмотрим схему молекулярных орбиталей молекулы воды (рис.3)
Для построения (Подробнее см. Г. Грей "Электроны и химическая связь",М., изд-во "Мир", 1967, с.155-62 и G. L.Miessier, D. A.Tarr, "Inorganic Chemistry", Prantice Hall Int. Inc., 1991, p.153-57) схемы МО молекулы Н2О совместим начало координат с атомом кислорода, а атомы водорода расположим в плоскости xz (рис.3). Перекрывание 2s- и 2p-АО кислорода с 1s-АО водорода показано на рис.4. В формировании МО принимают участие АО водорода и кислорода, обладающие одинаковой симметрией и близкими энергиями. Однако вклад АО в образование МО разный, что отражается в разных величинах коэффициентов в соответствующих линейных комбинациях АО. Взаимодействие (перекрывание) 1s-АО водорода, 2s — и 2рz-АО кислорода приводит к образованию 2a1-связывающей и 4a1-разрыхляющей МО.
 2015-01-30
2015-01-30 2197
2197
