Рассмотрим обратимую полуреакцию
Ox + n e– «Red тв,
где Ox – окисленная форма; Red – восстановленная форма.
Скорость электродной реакции зависит от приложенного потен-циала, который можно выразить уравнением Нернста
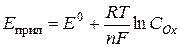 .
.
В процессе электролиза, т.е. при осаждении металла, потенциал электрода падает по мере снижения концентрации катиона металла в растворе COх.
Полноту протекания электролиза можно предсказать исходя из при-ложенного потенциала и уравнения Нернста. Если считать, что начальная концентрация Оx равна C 0; Е 0 – стандартный электродный потенциал; х – доля Ох, восстановленного до Red при потенциале электрода Е,то при равновесии число молей Ох составляет С 0×(1 – х).
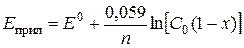 .
.
Например, при степени протекания электролиза 99,99% (х = 0,9999) потенциал рабочего электрода становится на 236/ n мВ отрицательнее, чем Е 0. На основании приведенных расчетов можно найти теоретическую разность стандартных потенциалов, необходимую для определения одного иона в присутствии другого. Она составляет 240 мВ (25 оС) для однозаряд-ных ионов и 120 мВ для двухзарядных.
 2015-01-30
2015-01-30 613
613








