| Окислитель | Восстановитель | Электронное уравнение | Условия реакции |
| MnO4- | Mn+7О4- +5e → Mn2+ | pH <7 | |
| Mn+7O4- +3e → Mn4+O2 | pH – 7 | ||
| Mn4+O4- + 1e → Mn6+O42- | pH >7 | ||
| H2O2 | H2O-12 + 2e →2OH- | ||
| H2O-12 – 2e → 1/2O2 +H2O2- | |||
| CrO42- (Cr2O72-) | Cr+6O42- + 3e → Cr3+ | pH<7 | |
| Cr+6O42- + 3e → Cr3+O2-1 | pH>7 | ||
| Cl2 (F2, Br2, I2) | Cl20 +2e → 2Cl- | ||
| HNO3(конц) | Fe, Cr, Al, Au, Pt, Ir, Ta | Не реагирует | |
| Тяжелые металлы | N+5O3- + e →N+4O2 | ||
| Щелочные и щелочно-земельные металлы | 2N+5O3- + 8e →N2+1O | ||
| HNO3 (разб.) | Тяжелые металлы | N+5O3- + 3e →N+2O | |
| Щелочные и щелочно-земельные металлы, Zn, Fe | N+5O3- +8e → N-3H3 | ||
| H2SO4 (конц.) | Au, Pt, Ir,Ta | Не реагируют | |
| Другие металлы | S+6O42- + 2e →S+4O2 | ||
| O2 | O2 + 4H+ +4e →2H2O | ||
| O2 | O2 + 2H2O + 4e → 4OH- | ||
| O3 | O3 +2H+ + 2e → O2 +2H2O | ||
| O3 | O3 +H2O + 2e → O2 +4OH- | ||
| HNO3+3HCl (царская водка) | N+5O3- + 4H+ + 3e →N+2O +2H2O | ||
| Mе(N03)n Me – металлы в соответствии с их положением в ряду напряжений (р.н.) | Me(NO3)n → Me(NO2)n+ 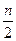 O2 O2 | Левее Mg в р.н. | |
2Me(NO3)n → Me2On + 2nNO2+ 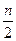 O2 O2 | От Mg до Cu в р.н. | ||
Me(NO3)n → Me + nNO2 + 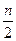 O2 O2 | Правее Cu в р.н. |
Определение основных продуктов ОВР
|
|

Сейчас читают про:
 2015-01-30
2015-01-30 820
820







