Основные окислители – это вещества, элементы которых находятся в максимальной степени окисления. Они могут только принимать электроны:
| +7 | +6 | +6 | +5 | +5 | ||
| KMnO4 | K2Cr2O7 | H2SO4 | HClO4 | HNO3 | O2 | F2 |
Основные восстановители – это вещества, элементы которых находятся в минимальной степени окисления. Они могут только отдавать электроны:
| -1 | -1 | -1 | -3 | -2 |
| HCl | HBr | HI | NH3 | H2S |
И окислители, и восстановители – это вещества, элементы которых находятся в промежуточной степени окисления. С сильными окислителями они восстановители, с сильными восстановителями они окислители:
| +2 | +4 | +3 | -1 |
| FeSO4 | Na2SO3 | HNO2 | H2O2 |
Определениеэквивалентов окислителя и восстановителяосуществляется путем деления молярной массы окислителя (восстановителя) на число принятых (отданных) электронов.
Задача 1. Укажите степень окисления каждого атома в веществах А, В и С. Определите окислительно-восстановительные свойства веществ А, В и С.
| Вещества, уравнения реакций |
| А – KNO2; В - KMnO4; С - NH3 |
Cтепень окисления каждого атома в веществах:
| +1 +3 -2 | +1 +7 -2 | -3 +1 |
| А:KNO2 | В:KMnO4 | С: NH3 |
Окислительно-восстановительные свойства веществ:
|
|
|
А: KNO2 содержит азот в промежуточной степени окисления N+3, следовательно, может являться и восстановителем и окислителем;
В: KMnO4 содержит марганец в высшей степени окисления Mn+7, следовательно, может являться только окислителем;
С: NH3 содержит азот в низшей степени окисления N-3, следовательно, может являться только восстановителем.
Задача 2. Напишите уравнения реакций, данных в вашем варианте, найдите коэффициенты в этих уравнениях методом электронного баланса. Рассчитайте эквиваленты окислителя и восстановителя в этих реакциях.
1. KNO2 + KMnO4 + H2SO4 → MnSO4 + …
2. KNO2 + NH3 → N2 + …
Уравнения реакций, электронный баланс, расчет эквивалентов окислителя и восстановителя:
1. K N+3O2 + KMn+7O4 + H2SO4 → MnSO4 + …
 N+3 – 2ē → N+5 5 - восстановитель
N+3 – 2ē → N+5 5 - восстановитель
Mn+7 + 5ē → Mn+2 2 - окислитель
5 KNO2 + 2 KMnO4 + 3 H2SO4 → 2 MnSO4 + 5 KNO3 + К2SO4 + 3 H2O
Э(KNO2) = 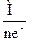 =
= 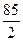 = 42,5 г/моль-экв
= 42,5 г/моль-экв
Э(KMnO4) = 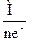 =
= 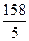 = 31,6 г/моль-экв
= 31,6 г/моль-экв
2.KN+3O2 + N–3H3 → N2 + …
 |
N+3 + 3ē → N0 1 - окислитель
N–3 – 3ē → N0 1 - восстановитель
KN+3O2 + N–3H3 → N2 + КОН + H2O
Э(KNO2) = 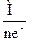 =
= 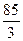 = 28,3 г-экв /моль
= 28,3 г-экв /моль
Э(NH3) = 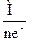 =
= 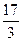 = 5,7 г-экв /моль
= 5,7 г-экв /моль
Электрохимические процессы – это процессы взаимного превращения химической и электрической форм энергии. Их делят на две основные группы:
1. Процесс превращения химической энергии в электрическую – это гальванические элементы.
2. Процесс превращения электрической энергии в химическую – это электролиз.
Гальваническим элементом (химическим источником тока ХИТ) называется устройство, преобразующее энергию химических реакций в электрическую. Гальванический элемент состоит их двух (как правило, выполненных из различных материалов) проводников 1 рода, соединенных проводником 2 рода.
|
|
|
К проводникам 1 рода (с электронной проводимостью) относятся графит, большинство металлов и их сплавов. К проводникам 2 рода (с ионной проводимостью) относятся растворы и расплавы электролитов. На границе раздела двух проводников возникает контактная разность потенциалов, причем в случае контакта проводника 1 и 2 рода она значительно больше (~1 В), чем при контакте проводников 1 и 1 рода (~ 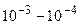 В) или 2 и 2 рода (~
В) или 2 и 2 рода (~ 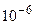 В). Контактная разность потенциалов возникает вследствие концентрации на поверхности раздела проводников положительных (на одном проводнике) и отрицательных (на другом проводнике) зарядов, в результате чего возникает система из двух электрически заряженных слоев, называемая двойным электрическим слоем. Такая система, по сути, является электрическим конденсатором. При замыкании проводников 1 рода, образующих гальванический элемент (электродов), любым проводником 1 рода (внешняя цепь) из-за различия электрических потенциалов электродов по внешней цепи протекает электронный ток, а по внутренней (проводник 2 рода) - ионный ток..
В). Контактная разность потенциалов возникает вследствие концентрации на поверхности раздела проводников положительных (на одном проводнике) и отрицательных (на другом проводнике) зарядов, в результате чего возникает система из двух электрически заряженных слоев, называемая двойным электрическим слоем. Такая система, по сути, является электрическим конденсатором. При замыкании проводников 1 рода, образующих гальванический элемент (электродов), любым проводником 1 рода (внешняя цепь) из-за различия электрических потенциалов электродов по внешней цепи протекает электронный ток, а по внутренней (проводник 2 рода) - ионный ток..
В процессе переноса электрического заряда с одного электрода на другой на поверхности электродов протекают окислительно-восстановительные реакции, называемые электродными реакциями. Электрод, имеющий меньший потенциал, на котором идет реакция окисления, называется анодом. Электрод, имеющий больший потенциал, на котором идет реакция восстановления, называется катодом.
В схеме одна разделительная черта обозначает поверхность раздела электрода (например, цинкового Zn) и электролита, причем для характеристики электролита указывают ионы, образующие двойной электрический слой и влияющие на потенциал электрода (например Zn2+) – Zn|Zn2+. Двойная разделительная черта в схеме символизирует соединение двух полуэлементов (например, пористую перегородку или хлоркалиевую трубку). Иногда для более полной характеристики гальванического элемента в схеме указывают также анионы и концентрацию соответствующего электролита, например:
Zn|0,1M Zn2+|| 0,5M Cu2+|Cu.
Таким образом, схема гальванического элемента является упрощенным описанием устройства элемента.
Потенциал электрода может быть определен теоретически или экспериментально. Рассчитать электродный потенциал можно с помощью уравнения Нернста:
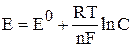 , где E – электродный потенциал, В; E0 – стандартный электродный потенциал, В; R– газовая постоянная; T – абсолютная температура полуэлемента, К; F – число Фарадея; C – молярная концентрация ионов электролита, определяющих потенциал электрода, моль/л; n – число электронов, отданных или принятых в соответствующей электродной реакции.
, где E – электродный потенциал, В; E0 – стандартный электродный потенциал, В; R– газовая постоянная; T – абсолютная температура полуэлемента, К; F – число Фарадея; C – молярная концентрация ионов электролита, определяющих потенциал электрода, моль/л; n – число электронов, отданных или принятых в соответствующей электродной реакции.
Например, в медно-цинковом элементе в катодном процессе (Cu2+ + 2e → Cu) два электрона (n= 2) в расчете на один катион. При концентрации ионов С= 1 моль/л и T = 298 К Е0 = E. Подставим в уравнение Нернста значения R = 8,3 Дж/моль К, T = 298 К (25°С), F = 96500 Кл и перейдем от натурального логарифма к десятичному, получив упрощенное уравнение Нернста (для стандартных условий t = 25 °C, Р = 1 атм)
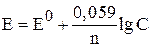 .
.
Величина разности потенциалов катода (EKt) и анода (EAn), DE = Ekt - EAn определенная при разомкнутой внешней цепи, называется электродвижущей силой (ЭДС) гальванического элемента. Поскольку Ekt > EAn, DE >0. Однако измерить ЭДС без замыкания внешней цепи невозможно, поэтому определяемые экспериментально значения ЭДС всегда несколько меньше теоретических. По величине ЭДС можно рассчитать изменения изобарно-изотермического потенциала в реакции, протекающей в гальваническом элементе:
ΔG = -(nKtFEKt - nAnFEAn), или, при nKt = nAn = n, ΔG = -nFΔE,
где ΔG – изменение изобарно-изотермического потенциала в ходе электродной реакции (Дж/моль); F – число Фарадея; EKt и EAn потенциалы катода и анода соответственно; nKt- число электронов, принятых на катоде; nAn- число электронов, отданных на аноде.
|
|
|
Электролизом называется совокупность химических и физико-химических процессов, протекающих при прохождении через вещество электрического тока. Различают первичные (основные) и вторичные (побочные) реакции и процессы. Первичными процессами являются окислительно-восстановительные реакции, протекающие на поверхности электродов: окисление на аноде анионов, атомов и молекул растворенного вещества или материала анода; восстановление на катоде катионов, атомов и молекул растворенного вещества. Вторичными процессами являются: перенос ионов к электродам, разрушение гидратных комплексов, внедрение образующихся на электродах веществ в кристаллическую решетку материала электрода и т.д.
Электролиз проводят при постоянном токе. Реакции на электродах являются эндотермическими. Необходимая для их протекания энергия подводится от внешнего источника электрической энергии (выпрямителя, включенного в сеть, гальванического элемента).
Электролиз проводят в электролизере – емкости, заполненной жидким раствором или расплавом электролита. В электролизер опускаются два электрода, выполненные из твердого электропроводящего материала, к которым подключается источник электрической энергии (например, аккумулятор или выпрямитель, подключенный к сети).
Различают электролиз с нерастворимым анодом (выполненным из химически инертных материалов: C, Pt, Au, Os, Ir) и растворимым анодом (выполненным из химически активных материалов: большинство металлов, например, цинк, медь, железо, свинец и др.).
При электролизе на катоде катионы электролитов восстанавливаются в соответствии с уменьшением их электродных потенциалов Е. Такая последовательность для стандартных электродных потенциалов носит название ряда напряжения (активности) металлов. Теоретически ионы, имеющие электродные потенциалы, меньшие 0 (потенциал водорода), не могут разряжаться на катоде в водных растворах. Однако, из-за перенапряжения металлы, стоящие в ряду напряжения от водорода до марганца, могут выделяться на катоде одновременно с водородом, причем соотношение выделившихся количеств металла и водорода зависит от условий электролиза. Катионы металлов, стоящих в ряду напряжения выше алюминия, не восстанавливаются в водных растворах, их можно выделить только из расплавов соответствующих электролитов.
|
|
|
При электролизе на аноде вещество окисляется в порядке увеличения электродных потенциалов. Сначала окисляется растворимый анод, затем (в случае нерастворимого анода) анионы, не содержащие кислород (Cl-, S2-, Br- и др.), затем анионы OH-. Содержащие кислород анионы (SO42-, NO3-, PO43- и др.), как правило, не окисляются в водных растворах, так же, как и нерастворимый анод.
Количество выделившегося на электроде вещества рассчитывают по обобщенному закону Фарадея:
mт = 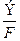 Iτ,
Iτ,
где mт – масса выделившегося на электроде вещества, г;
Э– молярная масса эквивалента выделившегося вещества, г/моль;
F – число Фарадея (Kл), равное произведению заряда электрона qe на число Авогадро NA, (F = qeNA = 1,6∙10-19∙6∙1023 ≈ 96500 Kл);
I – сила тока (А); τ – время электролиза, с.
Выходом по току (η) называется отношение массы практически выделившегося на электроде вещества (mп) к массе, рассчитанной по уравнению Фарадея (теоретической массе mт): η = 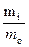 ∙100.
∙100.
Энергию (Е), затраченную на электролиз при постоянном напряжении, можно рассчитать по формуле: E = UIτ,где Е – затраченная энергия, Дж (1 кВт∙ч= = 3,6∙106 Дж); U – напряжение при электролизе, В; I – сила тока, А; τ – время электролиза, c.
Экспериментально определить абсолютное значение электродного потенциала невозможно. Поэтому на практике измеряется разность потенциалов между электродным потенциалом исследуемой системы и потенциалом электрода сравнения.
Задача 1. Напишите уравнения электродных процессов при электролизе водного раствора соли А с инертными электродами. Рассчитайте массы веществ, выделившихся на катоде и аноде при данной силе тока I за время t: 1)CuBr2, I = 8A, t = 2 час; 2) NaBr, I = 5A, t = 1 час; 3) KNO3, I = 6A, t = 3 часа.
1) CuBr2 : стандартный электродный потенциал меди Е0(Cu+2/Cu0), больше стандартного электродного потенциала водорода Е0(Н+/  Н2), следовательно, на катоде (Kt) образуется медь.
Н2), следовательно, на катоде (Kt) образуется медь.
Катодная реакция: Cu+2 + 2ē → Cu0
Анион кислоты (Br–) не содержит кислород, следовательно, на аноде (An) окисляется Br–.
Анодная реакция: 2 Br– – 2ē → Br2 0
Массы веществ, выделившихся на катоде и аноде, рассчитываются по уравнению Фарадея:
m = 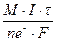 , где М – молярная масса вещества, которое образуется на электроде; I – сила, тока, А; τ – время, сек; nе– – количество электронов, участвующих в электродном процессе; F – число Фарадея, 96500 Кл.
, где М – молярная масса вещества, которое образуется на электроде; I – сила, тока, А; τ – время, сек; nе– – количество электронов, участвующих в электродном процессе; F – число Фарадея, 96500 Кл.
m(Cu) = 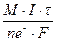 =
= 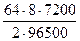 = 19,1г
= 19,1г
m(Br2) = 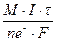 =
= 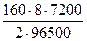 = 47,75г
= 47,75г
2) NaBr: Стандартный электродный потенциал натрия Е0(Na+/Na0), меньше стандартного электродного потенциала водорода Е0(Н+/ 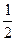 Н2), следовательно, на катоде (Kt) восстанавливается водород.
Н2), следовательно, на катоде (Kt) восстанавливается водород.
Катодная реакция: 2H2O + 2ē → H2 + 2 OH–
Анион кислоты (Br–) не содержит кислород, следовательно, на аноде (An) окисляется Br–.
Анодная реакция: 2 Br– – 2ē → Br2 0
Массы веществ, выделившихся на катоде и аноде, рассчитываются по уравнению Фарадея:
m = 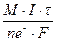 .
.
m(H2) = 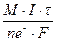 =
= 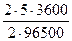 = 0,19г
= 0,19г
m(Br2) = 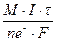 =
= 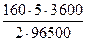 = 14,9г
= 14,9г
3) KNO3: стандартный электродный потенциал калия Е0(К+/К0), меньше стандартного электродного потенциала водорода Е0(Н+/ 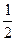 Н2), следовательно, на катоде (Kt) восстанавливается водород.
Н2), следовательно, на катоде (Kt) восстанавливается водород.
Катодная реакция: 2H2O + 2ē → H2 + 2 OH–
Анион кислоты (NO3–) содержит кислород, следовательно, на аноде (An) окисляется вода Н2О.
Анодная реакция: 2 Н2О – 4ē → О2 0 + 4 H+
Массы веществ, выделившихся на катоде и аноде, рассчитываются по уравнению Фарадея:
m = 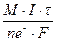
m(H2) = 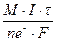 =
= 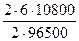 = 0,67г
= 0,67г
m(О2) = 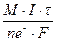 =
= 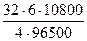 = 5,37г
= 5,37г
Задача 2. Напишите уравнение электродных процессов при электролизе водного раствора ZnSO4 с инертными электродами. Рассчитайте массу металла, выделившегося на катоде, если сила тока I = 5А, время электролиза τ = 2 часа, выход металла по току η = 80%.
При электролизе раствора ZnSO4 на катоде будет одновременно происходить восстановление металла и водорода:
Катодные реакции: Zn+2 + 2ē → Zn0
2H2O + 2ē → H2 + 2 OH–
Анион кислоты SO42- содержит кислород, следовательно на аноде будет окисляться вода:
Анодная реакция: 2 Н2О – 4ē → О2 0 + 4 H+
Для расчета массы цинка используется уравнение Фарадея с учетом выхода по току. Выход по току для расчета нужно брать в долях η = 80% = 0,8.
m(Zn) = 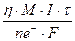 =
= 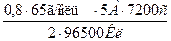 = 9,7г.
= 9,7г.
Задача 3. Пользуясь таблицей стандартных электродных потенциалов, составьте схему гальванического элемента, состоящего из двух металлов, погруженных в растворы их солей с данными концентрациями. Напишите уравнения катодного и анодного процессов, токообразующую реакцию и рассчитайте ЭДС этого элемента.
| Металл | Соль | Концентрация соли |
| Cr | Cr(NO3)3 | 0,1моль/л |
| Sn | SnCl2 | 0,01моль/л |
По таблице стандартных электродных потенциалов находим:
Е0(Cr3+/ Cr 0) = –0,744В
Е0(Sn2+/ Sn 0) = –0,136В
Е0(Cr3+/ Cr 0)< Е0(Sn2+/ Sn 0), следовательно, в данной схеме хром будет являться анодом, а олово – катодом. Составляем схему гальванического элемента:
Cr 0│ Cr3+║ Sn2+│ Sn 0
Анодный процесс: Cr 0 – 3ē → Cr3+
Катодный процесс: Sn2+ + 2ē → Sn 0
Токообразующая реакция (ТОР): 2Cr 0 +3 Sn2+→ 2Cr3+ + 3Sn 0
Расчет потенциала данного металла, погруженного в раствор его соли с концентрацией СМ проводится с помощью уравнения Нернста:
ЕМеn+/Ме0 = Е0Меn+/Ме0 + 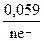 ∙ lg CM:
∙ lg CM:
Е0(Cr3+/ Cr 0) = –0,744В, СМ (раствора соли)= 0,1 моль/л = 10–1 моль/л
электродный процесс: Cr 0 – 3ē → Cr3+
Е Cr3+/ Cr0 = Е0 Cr3+/ Cr0 + 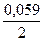 ∙ lg 10–1 = –0,774В + 0,0295 ∙ (-1) = -0,804В
∙ lg 10–1 = –0,774В + 0,0295 ∙ (-1) = -0,804В
Е0(Sn2+/ Sn 0) = –0,136В, СМ (раствора соли)= 0,01 моль/л = 10–2 моль/л
электродный процесс: Sn2+ + 2ē → Sn 0
Е Sn2+/ Sn 0= Е0 Sn2+/ Sn 0 + 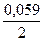 ∙ lg 10–2 = –0,136В + 0,0295 ∙ (-2) = -0,195В
∙ lg 10–2 = –0,136В + 0,0295 ∙ (-2) = -0,195В
Электродвижущая сила реакции (ЭДС):
ЭДС = Е0(Sn2+/ Sn 0) – Е0(Zn2+/ Zn 0) = –0,195В – (–0,804В) = 0,609 В
КОРРОЗИЯ МЕТАЛЛОВ
Конструкционные материалы, используемые в сельскохозяйственном производстве, всегда испытывают физическое и химическое воздействие со стороны окружающей среды. Такое воздействие приводит, как правило, к разрушению конструкционного материала.
Основными конструкционными материалами, используемыми в сельскохозяйственном машиностроении, являются металлы и их сплавы. Разрушение металлов и их сплавов под действием окружающей среды называется коррозией. Главную роль в процессе коррозии играют окислительно-восстановительные реакции между металлами и окисляющими компонентами окружающей среды (молекулами O2, ионами H+ и др.). По внешним признакам различают коррозию общую (по всей поверхности) и местную (пятнами, точечную, межкристаллическую).
По механизму различают коррозию химическую, электрохимическую, электрическую (под действием внешних источников тока), биологическую (под действием живых организмов, например, железобактерий).
Химической коррозией называется окислительно-восстановительная реакция между металлом и компонентами окружающей среды, протекающая с переносом электронов на расстояния соизмеримые с размерами атомов и молекул. Химическая коррозия может протекать в отсутствии электролитов (например, коррозия стали на воздухе) и в присутствии электролитов (например, коррозия стали в кислой среде).
Электрохимической коррозией называются окислительно-восстановительные реакции между металлами и компонентами окружающей среды, протекающие с переносом электронов на расстояния, значительно превышающие размеры атомов и молекул. Электрохимическая коррозия протекает, как правило, в присутствии электролита. Причиной электрохимической коррозии является возникновение контактной разности потенциалов при соприкосновении различных по химическим свойствам материалов (железо и зерна углерода в стали, железо и цинковое покрытие на нем и т.д.). Например, в сплавах возникают микрогальванопары, образованные небольшими частицами компонентов сплава, соприкасающиеся между собой. При электрохимической коррозии окисляется прежде всего наиболее активный металл, имеющий наименьший электродный потенциал, причем скорость коррозии тем больше, чем больше разность электродных потенциалов двух контактирующих металлов (материалов).
Задача 1. Пользуясь таблицей стандартных электродных потенциалов, подберите анодное и катодное покрытие для металла (Fe). Напишите уравнения коррозии металла, протекающей а) на воздухе, б) во влажном воздухе, в) в кислой среде.
Защитные покрытия – это слои, искусственно создаваемые на поверхности металла. Чаще всего – это лаки, краски, эмали, оксидные плёнки, фосфатные покрытия. Но, кроме того, применяются и металлические покрытия: катодные и анодные. Если потенциал покрытия, Епкр > Е Ме, покрытие является катодным. например, железо покрывают Cu, Аg, Ni. В этом случае коррозии металла, железа, не происходит только, если покрытие целостно, на нём нет пор, трещин, механических повреждений. В случае нарушения покрытия под ним происходит разрушение защищаемого металла.
Выбираем в качестве катодного покрытия для заданного по условию задачи металла (Fe) олово (Sn), а в качестве анодного покрытия – цинк (Zn).
а) анод Fe| H2O + O2 | Sn катод б) анод Zn| H2O + O2 |Fe катод

 e е
e е
E0 Fe+2/Fe0 = -0,44 В E0 Sn+2/Sn0 = -0,136 В E0Zn+2/Zn0 = -0,763 В
В случае нарушения целостности покрытия процессы коррозии луженого железа:
Анодный процесс: Feo – 2ē → Fe2+
Катодный процесс: O2 + 2H2О + 4ē →4OH-
Суммарное уравнение процесса коррозии:
2Fe + O2 + 2H2O → 2Fe(OH)2
Процесс восстановления О2 идет на катоде: на металле, обладающем более положительным значением электродного потенциала.
Если потенциал покрытия – более отрицательный, то это анодное покрытие. При коррозии разрушается именно оно. Например, в случае оцинкованного железа происходят процессы:
Анодный процесс: Zno – 2ē → Zn2+
Катодный процесс: O2 + 2H2О + 4ē →4OH-
Суммарное уравнение: 2Zn + О2 + Н2О→ 2Zn(OH)2
Потенциал металла сильно зависит от состава среды. Покрытие из одного и того же металла может быть в разных условиях либо катодным, либо анодным. Например, если Fe, покрытое Sn, находится в растворе H2SO4, то Sn является катодным покрытием; если Fe с Sn-покрытием погружено в раствор органических кислот, Sn становится анодным покрытием.
Уравнения процесса коррозии данного в условии задачи металла:
на воздухе: 2 Fe + О2 → 2 FeО2
во влажном воздухе: 2 Fe + О2 +2 Н2О → 2 Fe(ОН)2
в кислой среде: Fe + 2 Н+ → Fe +2 + Н2
 2015-01-30
2015-01-30 3317
3317
