По закону Фарадея найдем, сколько марганца и хлора должно выделиться теоретически, и рассчитаем выход по току.
1) m(Mn)= Mэк(Mn)·I·t/F= (55/2·48250)/96500= 13,75 г;
ВT (Mn)=m(экс)·100/m(теор)= 6·100/13,75= 43,6%;
2) V0 (Cl2)=Vэк(Cl2)·I·t/F= (22,4/2·48250)/96500= 5,6 дм3
ВT (Cl2)= Vэк ·100/Vтеор= 5,3·100/5,6= 95%
Низкий выход по току марганца объясняется тем, что совместно с марганцем на катоде восстанавливается вода (см. приложение, табл.7) и часть электричества расходуется на этот процесс.
Схема электролиза раствора МnСl2
Катод(-): Mn2++2 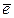 =Mn
=Mn 
2Н2О +2 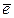 = H2 +2OH- 1; восстановление
= H2 +2OH- 1; восстановление
Анод (+): 2Сl- -2 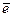 = Сl2 2; окисление
= Сl2 2; окисление
___________________________________________
Суммарный процесс: 2 MnСl2 + 2 Н2О–> H2 + Mn(OH)2 + 2 Сl2
 2015-01-30
2015-01-30 585
585








