§ Относительная молекулярная масса
Относительная молекулярная (или атомная) масса вещества (Mr) — отношение массы молекулы (или атома) (m0) данного вещества к 1/12 массы атома углерода (m0C).
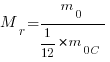
§ Постоянная Авогадро
Постоянная Авогадро — величина, равная числу молекул в одном моле; определяется числом молекул в 12 граммах углерода.
NA=6,02×1023
СИ: моль-1
§ Молярная масса
Молярная масса (M) вещества — это масса вещества, взятого в количестве одного моля и равная произведению массы молекулы (m0) на постоянную Авогадро (NA).
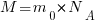
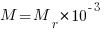
СИ: кг/моль
§ Количество вещества
Количество вещества (v) равно отношению:
1) числа молекул (N) в данном теле к постоянной Авогадро (NA), т.е. к числу молекул в одном моле вещества: 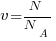 ;
;
2) массы вещества (m) к его молярной массе (М): 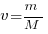
СИ: моль
§ Число молекул (атомов)
Число молекул (N) любого количества вещества массой (m) и молярной массой (М) равно: 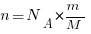
§ Концентрация молекул
Концентрация молекул (n) — это число молекул (N) в единице объёма (V), занимаемого этими молекулами, — определяется, как 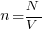
СИ: м3
§ Давление газа (основное уравнение молекулярно- кинетической теории газа)
Давление (p) газа на стенку сосуда пропорционально концентрации (n) молекул (атомов), массе (m0) одной молекулы (атома) и средней квадратичной скорости (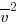 ) молекулы (атома).
) молекулы (атома).
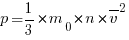
СИ: Па
§ Давление идеального газа
Давление идеального (p) газа пропорционально произведению концентрации молекул (n) на среднюю кинетическую энергию поступательного движения молекул (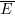 ).
).
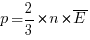
СИ: Па
 2015-01-30
2015-01-30 347
347








