Уравнение Ленгмюра 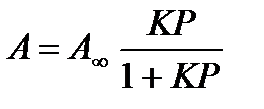 или
или 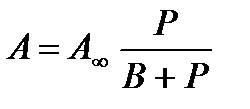 , где
, где 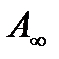 - количество моль адсорбтива при полном заполнении всех активных центров, К- константа равновесия, Р- давление газа, а
- количество моль адсорбтива при полном заполнении всех активных центров, К- константа равновесия, Р- давление газа, а
В = 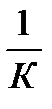 . Это уравнение объясняет линейную зависимость адсорбции при малом давлении
. Это уравнение объясняет линейную зависимость адсорбции при малом давлении
р  0, то
0, то 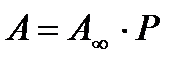 и плато на графике (рис.3) при высокой концентрации адсорбента р
и плато на графике (рис.3) при высокой концентрации адсорбента р 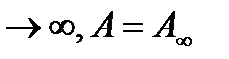
Адсорбция газов на твердом веществе существенно зависит от температуры. Чем выше температура, тем меньше адсорбция, и участок плато на изотерме адсорбции находится ниже. Поэтому кривая адсорбции может иметь более сложный вид, чем по уравнению Ленгмюра.
Если адсорбция на границе твердое тело – раствор, то для этого случая можно тоже использовать уравнение Ленгмюра, заменив в нем величину давления газа на молярную концентрацию раствора.
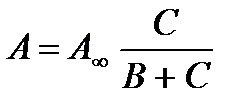 , это уравнение иногда называют уравнением Фрейндлиха. Т.е. зависимость та же, но она осложнена наличием растворителя, который тоже может адсорбироваться и всегда взаимодействует с растворенным веществом.
, это уравнение иногда называют уравнением Фрейндлиха. Т.е. зависимость та же, но она осложнена наличием растворителя, который тоже может адсорбироваться и всегда взаимодействует с растворенным веществом.
 2015-01-07
2015-01-07 824
824








