Для объяснения совокупности известных фактов, и прежде всего фактов, касающихся строения и свойств излучаемых атомами спектров, датский физик Нильс Бор (1913 г.) предложил теорию атома, в основу которой он положил три постулата:
1. Из бесконечного числа электронных орбит, возможных с точки зрения классической физики, в действительности осуществимы только некоторые стационарные орбиты. При движении по любой из них электрон не излучает энергии.
2. В атоме осуществляются только те орбиты, для которых момент количества движения электрона равен целому кратному величины h, т.е.
3. Излучение испускается или поглощается атомом при переходе электрона из одного квантового (стационарного) состояния в другое. Причем разность энергий этих двух состояний излучается или поглощается в виде кванта энергии  :
:
Квантовомеханическая теория водородоподобного атома строится на решении уравнения Шредингера:

В водородоподобном атоме потенциальная энергия электрона:

.
Подставляя ее в формулу, получим стационарное уравнение Шредингера для водородоподобного атома:
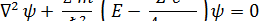
Можно показать, что это уравнение имеет требуемые (то есть,
однозначные, конечные, непрерывные и гладкие) решения в следующих случаях:
1. при любых положительных значениях E;
2. при дискретных отрицательных значениях энергии, равных:

(n = 1, 2, 3 ….)
Согласно решению уравнения Шредингера, собственным значениям энергии 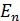 соответствуют собственные функции:
соответствуют собственные функции:

содержащие три целочисленных параметра: n l и m!.
Параметр n называют главным квантовым числом, совпадает с номером уровня энергии (n = 1,2,3 ….  ).
).
Параметр 1 представляет собой орбитальное квантовое число. Его физический заключается в том, что оно определяет модуль момента импульса (форму электронного облака):
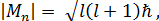
(1 = 0, 1, 2, 3,.... n – 1)
Параметр ml называется магнитным квантовым числом. Оно определяет значения проекции момента импульса на выбранное направление (z) в пространстве (ориентацию электронного облака):
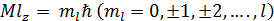
Всего возможно 21+1 значений магнитного квантового числа ml при данном l
Тонкая структура спектра атома водорода
Изотопический сдвиг. Для разных водородов идентичные переходы приводят к излучению света с отличающимися длинами волн. Это явление, известное как изотопический сдвиг линий, для атома водорода вполне удовлетворительно объясняется в рамках теории Борра. Учет конечности массы ядра приводит к тому, что волновое число перехода зависит от массы ядра. Поэтому линии изотопов, обусловленные одним и тем же квантовым переходом 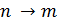 будут иметь различные длины волн.
будут иметь различные длины волн.
Тонкая структура линий. Для объяснения экспериментальных фактов (дублётная структура спектров щелочных металлов, опыт Штерна и Герлаха ….) наряду со спином допускается наличие у электрона магнитного момента, который связан со спином соотношением:

Так как проекция спина электрона 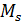 на любое избранное направление в пространстве может иметь лишь два значения
на любое избранное направление в пространстве может иметь лишь два значения 
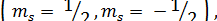 то и магнитны момент электрона относительно произвольной выбранной оси Z может ориентироваться лишь двумя способами, когда его проекции на это направление равны:
то и магнитны момент электрона относительно произвольной выбранной оси Z может ориентироваться лишь двумя способами, когда его проекции на это направление равны:
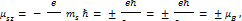
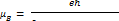
Наличие собственного момента у электрона и объясняет дублетный характер спектров атома водорода и щелочных металлов, так как оно приводит к дополнительному взаимодействию, которое называют спин-орбитальным.
 2015-01-07
2015-01-07 1158
1158
