При разделении двух растворов различной концентрации или раствора и чистого растворителя полупроницаемой перегородкой (мембраной) возникает поток растворителя от меньшей концентрации, к большей, выравнивающий концентрацию. Этот процесс называется – осмосом. Или - процесс односторонней диффузии растворителя через полунепроницаемую перегородку от раствора с меньшей концентрацией растворенного вещества к раствору с большей концентрацией называют осмосом.
Осмос характерен не только для истинных, но и для коллоидных растворов.
Зарисуем схему осмоса:
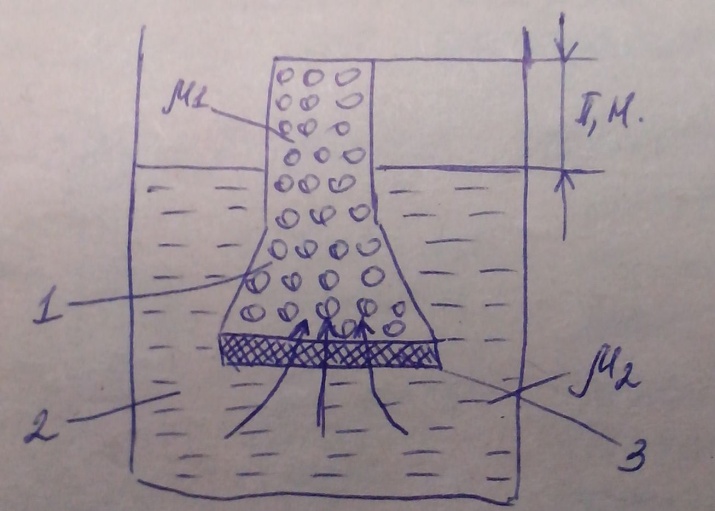
1- Сосуд с коллоидным раствором
2- Емкость с чистой жидкостью (растворителем)
3- Полупроницаемая перегородка (мембрана)
В сосуд, имеющий полупроницаемую перегородку 3, помещен коллоидный раствор 1. Полупроницаемая перегородка способна пропускать дисперсионную среду или растворитель, но является препятствием для коллоидных частиц или растворенных веществ. С наружной стороны перегородки находится чистая жидкость (растворитель) 2. Концентрация раствора по обе стороны перегородки будет различной. Внутри сосуда (1) часть раствора занимают молекулы растворенного вещества или частицы дисперсной фазы, поэтому концентрация жидкости (растворителя или дисперсионная среда) там будет меньше, чем в емкости 2 с чистой жидкостью. За счет диффузии жидкость из емкости 2 переходит в емкость 1.
Существует и термодинамическое объяснение осмотического переноса. Химический потенциал чистой жидкости 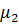 превышает химический потенциал этой же жидкости в растворе
превышает химический потенциал этой же жидкости в растворе 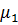 . Процесс самопроизвольный, идет в сторону меньшего химического потенциала до тех пор, пока не произойдет выравнивание химических потенциалов, т.е. до
. Процесс самопроизвольный, идет в сторону меньшего химического потенциала до тех пор, пока не произойдет выравнивание химических потенциалов, т.е. до 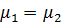 .
.
В результате перемещения жидкости, в емкости 1 создается избыточное давление 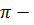 называемое осмотическим. Растворитель, проникающий в область раствора 1, поднимает уровень жидкости на высоту Н, что компенсирует давление чистого растворителя в сторону раствора. Наступает момент, когда вес столба жидкости в области раствора уравнивается давлением растворителя. Дальнейшего изменения уровня уже не произойдет, а вес столба жидкости над уровнем растворителя будет служить мерой осмотического давления.
называемое осмотическим. Растворитель, проникающий в область раствора 1, поднимает уровень жидкости на высоту Н, что компенсирует давление чистого растворителя в сторону раствора. Наступает момент, когда вес столба жидкости в области раствора уравнивается давлением растворителя. Дальнейшего изменения уровня уже не произойдет, а вес столба жидкости над уровнем растворителя будет служить мерой осмотического давления.
Осмотическое давление равно тому давлению, которое производила бы дисперсная фаза (растворенное вещество), если бы она в виде газа при той же температуре занимала тот же объем, что и коллоидная систем (раствор). Осмотическое давление возникает самопроизвольно.
Для чистого растворителя и идеального раствора не электролитов осмотическое давление выразится
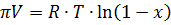 (1)
(1)
Где 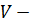 молекулярный объем растворителя;
молекулярный объем растворителя;
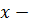 молярная доля растворенного вещества.
молярная доля растворенного вещества.
В случае разбавленных растворов неэлектролитов, когда 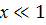 , можно запсать следующее уравнение:
, можно запсать следующее уравнение:
Согласно определению, осмотическое давление можно найти из уравнения состояния 2, где n – число молей растворенного вещества.
Если масса растворенного вещества равно g, а молекулярная его масс M, то n= 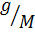 ; Тогда согласно (2)
; Тогда согласно (2) 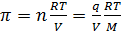 3
3
Величина  есть массовая концентрация растворенного вещества, поэтому можно записать
есть массовая концентрация растворенного вещества, поэтому можно записать
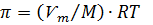 4
4
Формула является основной для определения осмотического давления. Она позволяет найти зависимость осмотического давления от размеров частиц растворенного вещества. Для этой цели массу дисперсной фазы можно представить в виде: M= m 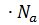 , m=
, m= 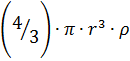 5
5
Где m,r – молекулярная масса и радиус частиц дисперсной фазы,
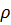 - плотность материала частиц.
- плотность материала частиц.
Подставив в уравнение 4 значение М из формулы 5 получим:
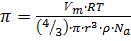 – для определения осмотического давления коллоидных растворов.
– для определения осмотического давления коллоидных растворов.
 2015-01-13
2015-01-13 2683
2683

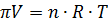 (2)
(2)