С 1 января 1963 г. введена Международная система единиц измерения (СИ), состоящая из шести основных единиц: метр(м) – длина, килограмм (кг) – масса, секунда(с) – время, ампер(А) – сила электрического тока, кельвин(К) – термодинамическая температура, кандела(кд) – сила света. ХIIIV Генеральная конференция по мерам и весам (1971) утвердила единицу количества вещества(моль) в качестве седьмой основной величины Международной системы. Моль (моль) равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в 0,012 кг изотопа углерода 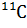 . В 0,012 кг углерода
. В 0,012 кг углерода 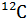 содержится 6,02
содержится 6,02 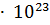 атомов углерода. Число частиц 6,02
атомов углерода. Число частиц 6,02 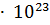 называется числом Авогадро. Если числу Авогадро приписать единицу
называется числом Авогадро. Если числу Авогадро приписать единицу 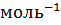 , то получится константа - постоянная Авогадро (обозначение
, то получится константа - постоянная Авогадро (обозначение 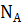 ):
): 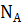 =6.02 • 1023 моль-1. Постоянная Авогадро показывает, что в одном моле любого вещества содержится 6 •
=6.02 • 1023 моль-1. Постоянная Авогадро показывает, что в одном моле любого вещества содержится 6 • 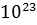 условных частиц. Условная частица (УЧ) - любой вид реальных частиц (атомы, молекулы, ионы, электроны, атомные группы и т.п.) и условно существующие доли таких частиц (
условных частиц. Условная частица (УЧ) - любой вид реальных частиц (атомы, молекулы, ионы, электроны, атомные группы и т.п.) и условно существующие доли таких частиц (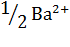 ,
, 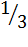
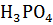 и т.п.).
и т.п.).
Молярная масса вещества, состоящего из частиц X (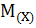 ), равна отношению массы m порции вещества к количеству вещества
), равна отношению массы m порции вещества к количеству вещества 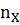 в этой порции:
в этой порции:
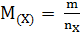 . Единица молярной массы - кг
. Единица молярной массы - кг  моль-1 или г
моль-1 или г  моль-1. Числовое
моль-1. Числовое
значение молярной массы {М}, выраженной в г  моль-1 или кг • моль-1, равно относительной молекулярной массе. Например,
моль-1 или кг • моль-1, равно относительной молекулярной массе. Например, 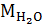 = 18 г
= 18 г  моль-1,
моль-1, 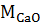 = 56 г
= 56 г  моль-1,
моль-1, 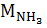 =17 г
=17 г  моль-1.
моль-1.
Относительной молекулярной массой Mr вещества называют отношение массы молекулы вещества к 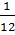 массы атома изотопа углерода 12С.
массы атома изотопа углерода 12С.
Количество вещества находится по следующим формулам:
n = 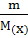 ; n =
; n = 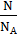 ; n =
; n = 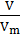 ;
;
где m - данная масса вещества, кг или г
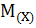 - его молярная масса, кг
- его молярная масса, кг  моль-1 или г
моль-1 или г  моль-1;
моль-1;
N - число частиц любой системы;
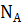 - постоянная Авогадро;
- постоянная Авогадро;
V - объем вещества (газа), 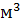 или л;
или л;
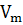 - молярный обьем газа,
- молярный обьем газа, 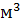
 моль-1или л
моль-1или л  моль-1.
моль-1.
Молярный объем газа 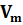 - постоянная величина - объем одного моля любого газа при нормальных условиях (р = 1.01 • 1О5 Па. Т =273 К).
- постоянная величина - объем одного моля любого газа при нормальных условиях (р = 1.01 • 1О5 Па. Т =273 К).
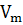 =22.4
=22.4 
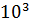
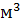
 моль-1или л
моль-1или л  моль-1.
моль-1.
Фактор эквивалентности 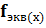 - число, равное той доле частицы х, которая является эквивалентом вещества в данной реакции.
- число, равное той доле частицы х, которая является эквивалентом вещества в данной реакции.
Эквивалент - реальная или условная частица, которая в кислотно-основных реакциях ионного обмена равноценна одному атому или одном иону водорода, а в окислительно-восстановительных реакциях одному электрону. Так, эквивалент серной кислоты в реакциях полной нейтрализации раавен  доле частицы х:
доле частицы х: 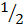
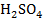 ; в реакциях неполной нейтрализации, когда
; в реакциях неполной нейтрализации, когда 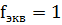 , эквивалент
, эквивалент 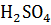 идентичен самой частице х:
идентичен самой частице х: 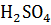 ; в окислительно- восстановительной реакции, когда сера принимает 2
; в окислительно- восстановительной реакции, когда сера принимает 2 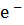 (окислитель)
(окислитель)
+6 +2 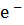 = +4
= +4
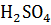
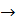
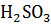 ,
, 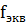 (
(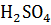 ) =
) = 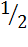
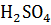 .
.
Массу одного моля эквивалента элемента называют молярной массой эквивалента 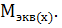 Значение эквивалента вещества зависит от того, в какой
Значение эквивалента вещества зависит от того, в какой
конкретной реакции участвует это вещество.
Молярная масса эквивалента химического элемента (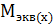 ), а также простых или сложных веществ рассчитывается по формуле
), а также простых или сложных веществ рассчитывается по формуле
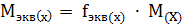
Фактор эквивалентности простого или сложного вещества, а также химического элемента равен единице, деленной на суммарную валентность химического элемента или вещества.
Для простых веществ суммарная валентность определяется произведением валентности атома химического элемента и числа атомов.
К сложным веществам относятся оксиды, гидроксиды, кислоты, соли.
Суммарная валентность оксидов равна произведению валентности кислорода (2) и количества атомов кислорода в молекуле. Суммарная валентность гидроксидов определяется их кислотностью, которая равняется числу замещенных гидроксильных групп. Суммарная валентность кислот равняется основности данных соединений, которая определяется числом замещенных атомов водорода. Суммарная валентность соли равняется произведению валентности катиона и количества катионов в молекуле, или валентности аниона и количества анионов в молекуле.
Молярная масса эквивалентов сложных веществ может быть определена как сумма молярных масс эквивалентов элементов или условных частиц, образующих данное вещество.
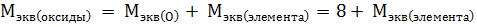 ,
,
т.к. 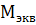 кислорода величина постоянная, равна 8 г
кислорода величина постоянная, равна 8 г  моль-1.
моль-1.
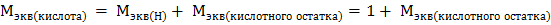 ,
,
т.к. 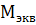 водорода величина постоянная, равна 1 г
водорода величина постоянная, равна 1 г  моль-1.
моль-1.
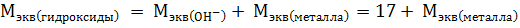 ,
,
т.к. 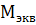 «ОН» величина постоянная, равна 17 г
«ОН» величина постоянная, равна 17 г  моль-1.
моль-1.
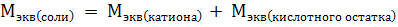 .
.
Эквивалент и его молярная масса могут быть найдены на основании закона эквивалентов, согласно которому химические элементы (сложные вещества) соединяются между собой или замещают друг друга в количествах, пропорциональных их молярным массам эквивалентов.
Пример 1. Определение молярной массы эквивалента элемента.
Рассчитайте молярную массу эквивалента металла и его атомную массу, если 1.215 • 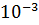 кг его вытесняют из серной кислоты 1.12 •
кг его вытесняют из серной кислоты 1.12 • 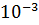
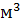 водорода (н.у.). Степень окисления металла в соединении +2.
водорода (н.у.). Степень окисления металла в соединении +2.
 2015-01-13
2015-01-13 539
539








