Ключевые слова: ионное произведение воды, водородный показатель (рН), гидроксильный показатель (рОН), кислота, основание, расчеты рН в растворах кислот и оснований.
Вода в очень малой степени находится в диссоциированном состоянии (очень слабый электролит): H2O H+ + OH –
H+ + OH –
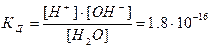 |
К её диссоциации можно применить закон действующих масс:
При столь малой константе диссоциации (КД), концентрация воды остается практически неизменной и равной: [H2O]=1000/18=55.6 моль/л. Произведение постоянных величин также постоянная величина: Kд∙[H2O] = [H+]∙[OH–].
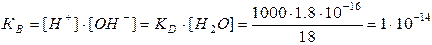 |
Таким образом, произведение молярных концентраций ионов водорода [H+] и гидроксильных групп [OH–] в любом водном растворе есть величина постоянная (при данной температуре) и называется ионным произведением воды (КВ). Диссоциация воды – процесс эндотермический, поэтому ионное произведение воды (КВ) зависит от температуры. С повышением температуры увеличивается концентрация [H+] и [OH–] ионов и величина ионного произведения: так, при 100оС: КВ = [H+][OH–] = 59∙10-14, при 0оС: КВ = [H+][OH–] = 0,139∙10-14.
В соответствии с теорией электролитической диссоциации ионы H+ являются носителями кислотных свойств, а ионы OH– - носителями основных свойств. Поэтому раствор будет нейтральным, при условии: [H+] = [OH–] =
10–7 моль/л; при [H+] > [OH–] – кислым; при [H+] < [OH–] – щелочным.
Концентрация катионов водорода [H+] обычно выражается очень малыми величинами. Для большего удобства принято пользоваться отрицательным значением десятичного логарифма молярной концентрации ионов [H+], который назван водородным показателем, и обозначается рН:
рН = –lg [H+], где [H+] - молярная концентрация ионов H+. Следовательно: [H+]= 10–pH
Если реакция среды нейтральная, то [H+] = 10–7 [моль/л], и рН=7. Если реакция среды кислая, то [H+]>10–7 [моль/л], и рН<7. Если среда щелочная, то [H+]<10–7 [моль/л], и рН>7. По аналогии рН введен гидроксильный показатель (рОН):
рОН = –lg [ОH- ], где [ОH- ] - молярная концентрация ионов ОH-. А также показатель константы воды: рКВ = –lg КВ. Логарифмируя ионное произведение воды получаем выражение: –lg [H+][OH–] = –lg 10–14 и далее: pH + pOH = 14.
Кислота (определение по Аррениусу) – это химическое соединение, которое в водном растворе полностью или частично диссоциирует на положительные ионы водорода и отрицательные ионы кислотного остатка.
 2014-04-05
2014-04-05 539
539








