Адсорбция бывает нелокализованная (молекулы адсорбата могут свободно перемещаться вдоль поверхности адсорбента). Локализованная адсорбция - это химическая или сильная физическая адсорбция, при которой адсорбированная молекула прочно связана с адсорбентом и не может перемещаться вдоль поверхности.
Мономолекулярная локализованная адсорбция описывается уравнением изотермы адсорбции Ленгмюра:

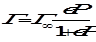 ,
,
где Г - величина адсорбции газа, Г∞ - максимально возможное количество адсорбированного вещества при образовании мономолекулярного слоя адсорбата, т. е. предельная адсорбция, в - константа адсорбционного равновесия, Р - равновесное давление газа. Уравнение (1.3), выраженное через степень заполнения Θ, имеет вид
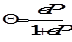 .
.
Степень заполнения определяется по соотношению:
Θ = Г/Г∞.
Изотерма адсорбции Ленгмюра может быть выражена черезобъем поглощенного газа:
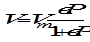
где V - объем адсорбированного газа, Vm - максимально возможный объем адсорбата, полностью покрывающего поверхность 1 г адсорбента. Объемы V и Vm приведены к нормальным условиям (н. у.).
Площадь поверхности 1 г адсорбента Sуд - удельная поверхность:
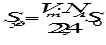 ,
,
где NA - число Авогадро, Vm выражен в литрах, 22,4 л - мольный объем газа при н. у., S0 - площадь, которую на поверхности адсорбента занимает 1 молекула адсорбата.
Адсорбция из раствора описывается уравнением Ленгмюра вида
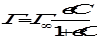 ,
,
где С – равновесная концентрация адсорбированного вещества в растворе, моль/м3.
Уравнение Ленгмюра можно привести к линейному виду, что позволит графически определить его константы в и Г∞.
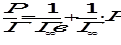
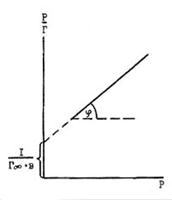
Рис. 1. Зависимость 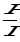 = f(P) к уравнению Ленгмюра
= f(P) к уравнению Ленгмюра
Это уравнение прямой в координатах 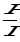 -Р (рис. 1.). Отрезок, отсекаемый на вертикальной оси, равен
-Р (рис. 1.). Отрезок, отсекаемый на вертикальной оси, равен 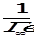 , actg φ = Г∞. Вместо Г и Г∞ могут быть использованы V и Vm соответственно, а вместо Р для адсорбции из раствора должна быть взята С. Величина Г∞ позволяет рассчитать удельную поверхность адсорбента по формуле:
, actg φ = Г∞. Вместо Г и Г∞ могут быть использованы V и Vm соответственно, а вместо Р для адсорбции из раствора должна быть взята С. Величина Г∞ позволяет рассчитать удельную поверхность адсорбента по формуле:
Sуд = Г∞NAS0.
При адсорбции происходит выделение теплоты. Теплота адсорбции вычисляется по уравнению Клапейрона - Клаузиуса, так как зависимость давления, необходимого для получения одной и той же степени заполнения Θ (или величины адсорбции Г) на 1 г адсорбента, от температуры аналогична зависимости «давление пара - температура»:
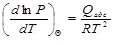 .
.
Интегрирование последнего выражения в пределах от Т1 до Т2 приводит к
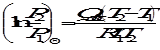 , откуда
, откуда
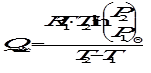 .
.
Уравнение изотермы адсорбции Ленгмюра на практике применимо в достаточно ограниченном диапазона величин  и лишь в редких случаях она выполняется во всем интервале степени заполнения поверхности от 0 до 1. Это говорит о том, что поверхность адсорбента, в основном, энергетически неоднородна.Об этом также свидетельствует зависимость теплоты адсорбции от степени заполнения, чего согласно теории Ленгмюра быть не должно. Кроме того, теория мономолекулярной адсорбции не может объяснить изотерму S – образной формы, наблюдаемую на практике, из которой следует, что адсорбция не заканчивается образованием монослояадсорбата, а продолжается дальше. Последнее явление получило объяснение с позиции полимолекулярной адсорбции. Было предложено несколько теорий полимолекулярной адсорбции, однако, наиболее приемлемой в настоящее время является теория БЭТ
и лишь в редких случаях она выполняется во всем интервале степени заполнения поверхности от 0 до 1. Это говорит о том, что поверхность адсорбента, в основном, энергетически неоднородна.Об этом также свидетельствует зависимость теплоты адсорбции от степени заполнения, чего согласно теории Ленгмюра быть не должно. Кроме того, теория мономолекулярной адсорбции не может объяснить изотерму S – образной формы, наблюдаемую на практике, из которой следует, что адсорбция не заканчивается образованием монослояадсорбата, а продолжается дальше. Последнее явление получило объяснение с позиции полимолекулярной адсорбции. Было предложено несколько теорий полимолекулярной адсорбции, однако, наиболее приемлемой в настоящее время является теория БЭТ
 2015-01-21
2015-01-21 3505
3505








