ΔG 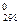 = ΔН
= ΔН 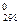 – ТΔS
– ТΔS 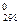 ;
;
ΔН 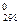 и ΔS
и ΔS 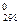 – функции состояния, поэтому
– функции состояния, поэтому
∆H298 = ∑ni∆Hпрод – ∑nj∆Hисх,
ΔS 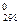 =ΣniS
=ΣniS 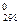 прод – ΣnjS
прод – ΣnjS 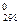 исход .
исход .
∆Н 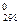 = (-393,51 + 0) – (-110,52 – 285,84) = 2,85 кДж,
= (-393,51 + 0) – (-110,52 – 285,84) = 2,85 кДж,
∆S 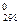 = (213,65 + 130,59) – (197,91 + 69,94) = 76,39 Дж/моль =
= (213,65 + 130,59) – (197,91 + 69,94) = 76,39 Дж/моль =
= 0,07639 кДж/К,
∆G 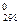 = +2,85 – 298 · 0,07639 = -19,91 кДж.
= +2,85 – 298 · 0,07639 = -19,91 кДж.
Пример 4. Восстановление Fe2O3 водородом протекает по уравнению Fe2O3(к) + 3Н2(г) = 2Fе(к) + 3Н2О(г); ΔН 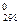 = 96,61кДж. Возможна ли эта реакция при стандартных условиях, если изменение энтропии ΔS
= 96,61кДж. Возможна ли эта реакция при стандартных условиях, если изменение энтропии ΔS 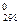 =0,1387 кДж/моль К? При какой температуре начнется восстановление Fe2O3?
=0,1387 кДж/моль К? При какой температуре начнется восстановление Fe2O3?
 2015-02-24
2015-02-24 411
411








