Электролизом называется окислительно-восстановительный процесс, протекающий при прохождении электрического тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую. Ячейка для электролиза, называемая электролизером, состоит из двух электродов и электролита. Электрод, на котором идет реакция восстановления (катод), у электролизера подключен к отрицательному полюсу внешнего источника тока. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника.
При электролизе на катоде (отрицательно заряженный электрод) происходит восстановление, а на аноде (положительно заряженный электрод) – окисление.
На характер течения электродных процессов при электролизе большое влияние оказывают состав электролита, растворитель, материал электродов и режим электролиза (напряжение, плотность тока, температура и др.). Прежде всего, надо различать электролиз расплавленных электролитов и их водных растворов.
Электролиз водных растворов электролитов более сложный процесс из-за возможности участия в нем молекул воды:
- восстановление на катоде: 2Н2О + 2ē = Н2↑ + 2OН– (рН≥7);
или: 2Н+ +2ē = Н2↑;
- окисление на аноде: 2Н2О – 4ē = 4H+ + О2.
Если на одном и том же электроде возможно протекание двух или более процессов, то вероятен тот, осуществление которого связано с минимальной затратой энергии. Это означает, что на катоде восстанавливаются, в первую очередь, окисленные формы окислительно-восстановительных систем с наибольшим электродным потенциалом, а на аноде окисляются восстановленные формы с наименьшим электродным потенциалом.
В реальных процессах этот порядок часто нарушается из-за перенапряжения на электродах, вызванного их поляризацией и другими побочными процессами. Поэтому для определения порядка протекания окислительно-восстановительных процессов на электродах при электролизе водных растворов можно руководствоваться следующими правилами.
На катоде:
- в первую очередь восстанавливаются катионы металлов, имеющие стандартный электродный потенциал 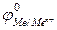 больший, чем у водорода, в порядке его уменьшения, например:
больший, чем у водорода, в порядке его уменьшения, например:
Сu2+ + 2ē → Сu0, 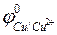 =+0,34В;
=+0,34В;
- катионы металлов с малым стандартным электродным потенциалом (от Li+ до Аl3+ включительно) не восстанавливаются, а вместо них восстанавливаются молекулы воды с выделением водорода:
2Н2О + 2ē= Н2↑ + 2OН–, 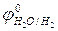 = -0,41В (рН≥7);
= -0,41В (рН≥7);
- катионы металлов, имеющие стандартный электродный потенциал меньший, чем у водорода, но больший, чем у алюминия, восстанавливаются одновременно с молекулами воды с выделением водорода.

- в растворах кислот (рН < 7) восстанавливаются ионы H+:
2Н+ + 2e→ Н2, 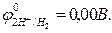
На аноде характер окислительных процессов зависит также от материала электродов. Различают нерастворимые (инертные) и растворимые (активные) электроды. Инертные электроды изготовляются обычно из графита, угля, платины. В процессе электролиза они химически не изменяются, а служат лишь для передачи электронов во внешнюю цепь. При использовании инертных анодов:
- в первую очередь окисляются простые ионы в порядке возрастания их 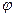 0, не превышающих +1,5 В (S2-, I–, Вr–, Сl–).
0, не превышающих +1,5 В (S2-, I–, Вr–, Сl–).
- при электролизе водных растворов, содержащих ионы кислородсодержащих кислот 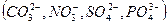 , на аноде окисляются не эти ионы, а молекулы воды с выделением кислорода:
, на аноде окисляются не эти ионы, а молекулы воды с выделением кислорода:
2Н2О – 4ē = 4H+ + О2, 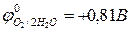 (рН ≤ 7)
(рН ≤ 7)
- в щелочных растворах (рН >7) на аноде окисляются ионы ОН–: 4OH- - 4e = O2 + 2H2O, 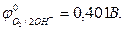
При использовании растворимых анодов (из меди, серебра, цинка и других металлов) анод посылает электроны во внешнюю цепь за счет окисления атомов металла, из которых он сделан:
Ме0 – ne→ Меn+.
Пример 1. Сколько граммов меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А?
 2015-02-24
2015-02-24 637
637








