191. Написать недостающие обозначения в реакции окисления железа с образованием ржавчины: 4Fe+∙∙∙=2Fe2O3. С каким веществом, при этом вступает в реакцию железо?
192. Написать недостающую химическую формулу вещества в реакции:
8Al+3Fe3O4=4Al2O3+∙∙∙∙∙
193. Определите количество вещества атомного железа в оксиде железа (III) массой 56 г. [n(Fe)=2n(Fe2O3)=2∙0?35=0,7 моль.].
194. Какая масса фосфора потребуется для получения фосфорной кислоты Н3РО4 массой 29,4 г? [m(P)=n(P)∙M(P)=0,3∙31=9,3 г].
195. Состав оксида неизвестного элемента (Х) выражается формулой ХО2. Известно, что для получения оксида (ХО2) массой 22,2 г потребуется элемент (Х) массой 15,8 г. Какой элемент образует оксид? [M(Х)=79 г/моль; элемент Х – это селен].
196. Какой объем займет при температуре 200С и давлении 250 кПа аммиак массой 51 г.? [V1(NH3)=P0T1V0(NH3)/(P1∙T0)=29,2 л].
197. При взаимодействии гидроксида железа (III) с серной кислотой образуется сульфат железа (III) Fe2(SO4) и вода – H2O. Напишите уравнение данной реакции. [2Fe(OH)3+3H2SO4=…….?].
198. Подберите коэффициенты в схеме окислительно – восстановительной реакции:
S+HNO3 → H2SO4+NO. [S0+H+1N+5O3-6 → H2+2S+6O4-8+N+2O-2. ].
199. При сжигании 0,1 моль углеводорода образовались оксид углерода () объемом 6,72 л (нормальные условия) и вода массой 7.2 г. Определите формулу углеводорода. [С3Н8 - пропан].
200. Массовая доля крахмала в картофеле составляет 20%. Рассчитайте массу глюкозы, которая может быть получена из картофеля массой 405 кг. Выход продукта равен η=70%. [mp(глюкозы)=m(глюкозы)∙η /100%=63 кг].
201. Химик, обрабатывая осадочную породу, получил 1,231∙10-2 г урана и 0,016∙10-2 г свинца. Сколько лет назад образовалась осадочная порода, если за 100 млн. лет из 1000 г урана получается 13 г свинца и 2 г гелия. [t=1,6∙109 лет].
202. Выровняйте уравнение окислительно-восстановительной реакции:
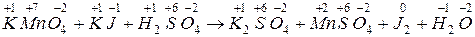
пользуясь методом электронного баланса, и в ответе укажите коэффициент около окислителя. [k=2].
203. Решите окислительно-восстановительную реакцию следующего типа:
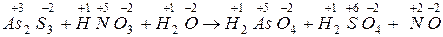 .
.
пользуясь методом электронного баланса, и в ответе укажите коэффициент около окислителя. [k=10].
204. Термохимическое уравнение реакции фотосинтеза:
(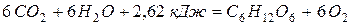 )
)
показывает, что в ходе реакции 6 молями углекислого газа со 6 молями воды поглощают 2,62 кДж энергии и образуется 1 моль сахарозы, и 6 молей молекулярного кислорода. Сколько израсходуется энергии для получения 3,6 кг сахарозы? [Q=52,4 кДж].
205. В ходе реакции брожения одного моля сахарозы:
(С6H12O6→2CH3CH2OH+2CO2+0,204 кДж)
выделяется 0,204 кДж энергии. Из сколько килограммов сахарозы можно получить 408 кДж энергии? [m=360 кг сахарозы].
206. В результате дыхания в живых организмах протекает реакция окисления сахарозы:
(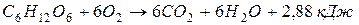 )
)
и из одного моля сахарозы выделяется 2,88 кДж энергии. Сколько килограммов молекулярного кислорода израсходуется для получения энергии в 5760 кДж? [m=384 кг].
207. Пользуясь данными задач 205 и 206, определите, во сколько раз эффективность выделения энергии больше при дыхании, чем при брожении сахарозы? [k=14,12 раза].
208. При расщеплении одной моли макроэнергетической связи (~) аденозинтрифосфорной кислоты (АТФК):
(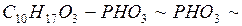 ….
…. 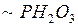 ),
),
выделяется 40 кДж энергии. Сколько граммов АТФК израсходуется для получения энергии в 600 кДж? [m=6390 г].
209. Давление водяного пара при 250С соствляет 3173 Па. Сколько молекул содержится в 1 мл этого пара? [N=n∙NA=7,71∙1017 молекул].
210. Смешали 400 граммов 50% раствора с 600 граммами 20% другого раствора данного вещества. Сколько процентов вещества содержится в полученном растворе? [w=32%].
……******……
 2015-02-24
2015-02-24 774
774








