Вид диаграммы состояния зависит от того, какие фазы образуют оба компонента. Свойства сплава также зависят от того, какие соединения или какие фазы образовали компоненты сплава. Поэтому очевидно, что между видом диаграммы состояния и свойствами сплава должна существовать определенная связь.
На рис. 39 приведены четыре основных типа диаграмм состояния и соответствующие им закономерности изменения свойств сплава с изменением концентрации.
1. При образовании смесей (рис. 39, а) свойства изменяются по линейному закону. Следовательно, значения свойств сплава находятся в интервале между свойствами чистых компонентов.
2. При образовании твердых растворов (рис. 39, б) свойства сплава, в первую очередь электросопротивление, могут значительно отличаться от свойств компонентов. Следовательно, при образовании механической смеси электросопротивление повышается незначительно, при образовании твердого раствора - весьма сильно. Поэтому распад твердого раствора на две (или более) фазы приводит к повышению электропроводности (закон Курнакова).
|
|
|
3. При образовании ограниченных твердых растворов (рис.39, в) свойства в интервале концентраций, отвечающем однофазным твердым растворам, изменяются по криволинейному, а в двухфазной области диаграммы - по прямолинейному закону, причем крайние точки на прямой являются свойствами чистых фаз.
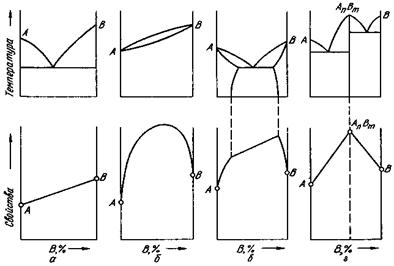
Рис.39. Свойства сплавов и их диаграммы состояния
4.При образовании химического соединения на диаграмме концентрация - свойства (рис.39, г) концентрация химического соединения отвечает максимуму (или минимуму) на кривой (в данном случае
перелом кривой). Эта точка перелома, соответствующая химическому соединению, называется сингулярной (особой) точкой. По диаграмме состав - свойства можно найти соотношение компонентов данного химического соединения, определяя, какой концентрации отвечает сингулярная точка.
Метод изучения изменений свойств в зависимости от изменения состава и построения диаграммы состав - свойства был положен Н.С. Курнаковым в основу разработанного им физико-химического анализа сплавов и нашел широкое применение в исследованиях новых сплавов.
Резюме
Диаграмма состояния представляет собой графическое изображение состояния сплава.
Общие закономерности сосуществования устойчивых фаз могут быть выражены в математической форме в виде правила фаз или закона Гиббса.
Правило фаз дает количественную зависимость между степенью свободы системы и количеством фаз компонентов.
Под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, давление, концентрация), которое можно изменять без изменения числа фаз в системе.
Правило фаз.
С= k - f + 2
С - число степеней свободы, k - число компонентов, f – число фаз, 2 – число внешних факторов.
Типы диаграмм состояния.
 2015-02-24
2015-02-24 609
609








