Рассмотрим зависимость химического равновесия от температуры с помощью принципа Ле-Шателье. Пусть наша реакция экзотермична, то есть идет слева направо с выделением тепла (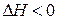 ). Кстати, отметим, когда равновесие установится, теплота не выделяется и не поглощается системой, иначе бы нарушился закон сохранения энергии (первое начало термодинамики). При нагревании системы в состоянии равновесия её температура начнёт повышаться. Чтобы скомпенсировать внешнее воздействие – рост температуры (сдержать её повышение), равновесие сдвинется влево – в сторону противоположной реакции, которая эндотермична (идет с поглощением тепла
). Кстати, отметим, когда равновесие установится, теплота не выделяется и не поглощается системой, иначе бы нарушился закон сохранения энергии (первое начало термодинамики). При нагревании системы в состоянии равновесия её температура начнёт повышаться. Чтобы скомпенсировать внешнее воздействие – рост температуры (сдержать её повышение), равновесие сдвинется влево – в сторону противоположной реакции, которая эндотермична (идет с поглощением тепла 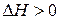 ). Поглощение тепла позволит системе по возможности сохранить своё состояние – неизменность температуры в равновесии. Если же эту систему охлаждать и её температура станет уменьшаться, равновесие, чтобы скомпенсировать внешнее воздействие, стремится в сторону экзотермической реакции, то есть вправо. Последняя реакция, выделяя тепло, приостановит понижение температуры.
). Поглощение тепла позволит системе по возможности сохранить своё состояние – неизменность температуры в равновесии. Если же эту систему охлаждать и её температура станет уменьшаться, равновесие, чтобы скомпенсировать внешнее воздействие, стремится в сторону экзотермической реакции, то есть вправо. Последняя реакция, выделяя тепло, приостановит понижение температуры.
Из изложенного видно, что влияние температуры на положение химического равновесия подчиняется следующему правилу: при повышении температуры химическое равновесие смещается в сторону эндотермической реакции, а при понижении температуры – в сторону экзотермической реакции. Примером может служить реакция синтеза аммиака, которая экзотермична (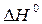 = –92 кДж).
= –92 кДж).
N2 + 3H2 Á 2 NH3; 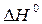 = –92 кДж.
= –92 кДж.
Нагревание системы приведет к смещению положения равновесия влево, в сторону исходных веществ – водорода и азота, а охлаждение – вправо, в сторону образования аммиака.
 2015-02-27
2015-02-27 543
543








