Пусть к моменту установления равновесия начальные концентрации C0А и С0В уменьшится на х молей. Так как из одного моля А и В образуется 2 моля вещества С, то ∆CС = 2 x моль/л. В начальный момент вещества С не было. Составим таблицу изменения концентраций:
| Концентрация | Вещества | ||
| А | В | С | |
| С0 | |||
| DС | х | х | 2 x |
| С | 3 – x | 5 – x | 2 x |
В выражение константы равновесия входят равновесные концентрации веществ:
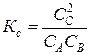 .
.
Подставив значения, получим:
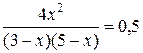 ;
;
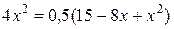 ;
; 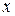 = 1 моль/л.
= 1 моль/л.
Таким образом, искомые равновесные концентрации равны:
СА = 3 – 1 = 2 моль/л; СВ = 5 – 1 = 4 моль/л; СС = 2∙1 = 2 моль/л.
Пример 2. В процессе синтеза аммиака N2 + 3H2 Á 2NH3 равновесие установилось при следующих концентрациях веществ (моль/л): 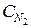 = 2,5;
= 2,5; 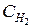 = 1,8;
= 1,8; 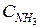 =3,6. Рассчитайте константу равновесия реакции и исходные концентрации азота и водорода. Начальная концентрация аммиака равна нулю.
=3,6. Рассчитайте константу равновесия реакции и исходные концентрации азота и водорода. Начальная концентрация аммиака равна нулю.
 2015-02-27
2015-02-27 800
800








