Хлорофилл, находящийся в фотосинтетических мембранах, служит своего рода природным датчиком состояния клеток водорослей. Энергия кванта света, поглощенного светособирающим комплексом, может быть превращена в энергию разделенных зарядов, которая используется в дальнейших реакциях фотосинтеза, либо потеряна путем излучения кванта флуоресценции или рассеяно в тепло.
Существует два наиболее вероятных для молекулы хлорофилла синглетных возбужденных уровня: более высокий (S*2) на который переходит электрон при поглощении кванта синего и более низкий (S*1) на который переходит электрон при поглощении кванта красного света (Рис.1). Это определяет наличие в спектре поглощения хлорофилла двух главных пиков, синего и красного максимума. При этом поглощение кванта синего света электрон попав на более высокий энергетический уровень, тотчас же падает обратно на «красную» орбиту.
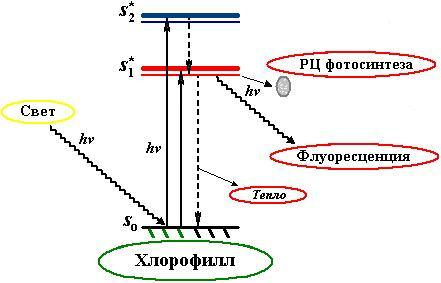
Рис. 1. Электронные переходы молекулы хлорофилла при поглощении квантов света. Прерывистые стрелки - безызлучательные переходы. Красная и синяя горизонтальные линии соответствуют поглощению квантов света в красной и синей области спектра.
Одним из путей дезактивации возбуждения (перехода молекулы из состояния S*1 в основное состояние) наряду с тепловой диссипацией и использованием при фотосинтезе является испускание квантов красного света, называемое флуоресценцией. Флуоресценция испускается при переходе молекулы из возбужденного синглетного состояния в основное. Время жизни флуоресценции для большинства органических молекул, в том числе и для хлорофилла, лежит в пределах от 10-9 до 10-6 с.
Реакционный центр ФС2 состоит из специальной молекулы хлорофилла P680, которая в возбужденном состоянии является первичным донором электрона для хинонного акцептора QA. Восстановление P680+ происходит очень быстро, менее чем за 1 мкс, а скорость окисления QA- значительно меньше и лимитируется темновыми реакциями. Состояние реакционного центра ФС2 в котором Р680 восстановлен и QA окислен, называется открытым. Через время порядка 1 мкс после разделения зарядов и появления первичной пары P680+ QA происходит восстановление P680+ от вторичных доноров. В результате РЦ оказывается в состоянии P680QA-, которое называется закрытым (Рис.2). Энергия кванта света, поглощенного в ФС2, может быть превращена в энергию разделенных зарядов P680+QA-, которая используется в дальнейших реакциях фотосинтеза, либо потеряна путем излучения кванта флуоресценции или рассеяния в тепло. Эти три процесса характеризуются константами скорости Kp, Kf и Kd, соответственно (Рис.2).
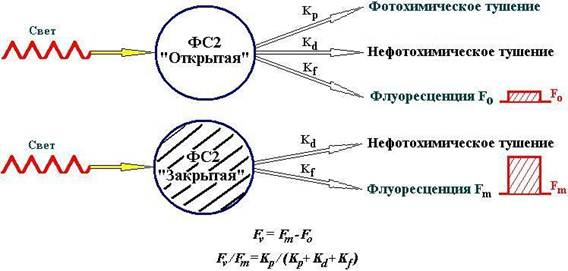
Рис. 2.Схема изменения эффективности использования световой энергии при открытых и закрытых реакционных центрах фотосистемы 2. При открытых РЦ ФС2 энергия поглощенных квантов света используется в фотосинтезе (Kp), рассеивается в тепло (Kd) и испускается в виде флуоресценции (Kf), выход флуоресценции низкий (F0). При закрытых РЦ ФС2 энергия не используется в фотосинтезе (Kp=0), а расходуется в нефотохимическое тушение (Kd) и во флуоресценцию (Kf), выход флуоресценции максимальный (Fm).
При открытом состоянии реакционных центров эффективность использования энергии возбуждения в фотосинтезе высока, вероятность потери энергии минимальна и квантовый выход флуоресценции, (F0 = Kf/(Kp + Kf + Kd)), минимален и составляет около 2%. Уровень постоянной флуоресценции F0 с высоким коэффициентом корреляции соответствует суммарному содержанию пигментов фотосинтетического аппарата фитопланктона, осуществляющих светосбор энергии и, соответственно, также коррелирует с обилием клеток водорослей. Поэтому он может быть использован для оценки ростовых процессов культур клеток. Снижение выхода флуоресценции хлорофилла в результате использования энергии света в первичных реакциях фотосинтеза называют фотохимическим тушением флуоресценции хлорофилла.
При закрытых реакционных центрах фотохимическое разделение зарядов становится невозможным, и квантовый выход флуоресценции возрастает до Fm = Kf/(Kf + Kd) и составляет около 5%. Разность между максимальным и минимальным выходом флуоресценции Fv = Fm – F0 называется переменной флуоресценцией. Эта величина пропорциональна той части энергии света, которая не используется в фотохимических реакциях фотосинтеза и теряется в виде флуоресценции и тепла при закрытых реакционных центрах. Из приведенных выше соотношений связи значений выхода флуоресценции при открытых и закрытых реакционных центрах следует одно из важнейших соотношений Fv/Fm = Kp/(Kp + Kf + Kd), т.е. отношение интенсивностей переменной и максимальной флуоресценции (относительный выход переменной флуоресценции) равно квантовому выходу использования энергии света открытыми реакционными центрами ФС2. По изменению этой величины можно судить об эффективности основного фотосинтетического запасания энергии электронного возбуждения Р680 в различных условиях. У водорослей в оптимальных условиях Fv/Fm близко к 0.7, а при действии токсикантов - уменьшается. У мертвых водорослей Fv/Fm=0. В настоящее время этот параметр флуоресценции как показатель состояния и эффективности функционирования фотосинтетического аппарата широко используются в фундаментальных и прикладных исследованиях.
Важным преимуществом флуоресцентных методов является их экспрессность и высокая чувствительность, что позволяет быстро диагностировать состояние клеток микроводорослей под действием токсикантов непосредственно в среде их обитания in situ в режиме реального времени. Оперативность измерений параметров флуоресценции имеет особое значение для раннего обнаружения появления полютантов в среде.
На кафедре биофизики биологического факультета МГУ разрабатываются методы и аппаратура для регистрации параметров быстрой флуоресценции флуоресценции хлорофилла на культурах микроводорослей и природном фитопланктоне непосредственно в среде его обитания in situ. В частности создан погружной зонд-флуориметр, позволяющий оценивать состояние фитопланктона в водоеме по глубине и по акватории и тем самым выявлять места антропогенных воздействий.
В данной задаче предлагается провести сравнительное исследование световых зависимостей и индукционных кривых параметров флуоресценции при действии различных концентраций солей тяжелых металлов у зеленых пресноводных водорослей.
 2015-02-27
2015-02-27 1083
1083
