q Построить графики зависимостей F0, Fm и Fv / Fm от времени инкубации при разных концентрациях сульфата меди (в процентах от контроля).
q Для опытных образцов с изменениями в значении Fv/Fm в 20-30 % построить графики световых зависимостей параметров флуоресценции Ft, Fm', Yield, qN, NPQ, rETR и сравнить с параметрами контрольного образца (см. для примера рис.7. с сульфатом меди).
q На основании полученных световых кривых rETR рассчитать следующие фотосинтетические параметры: коэффициент максимальной утилизации световой энергии (угол наклона световых кривой, α), максимальную относительную скорость электронов по электрон транспортной цепи (rETRmax) и насыщающую интенсивность света (Ен). Данные представить в таблице и сравнить с контрольным образцом (см. для примера таблицу с медью).
q Если для каждой пробы делалось несколько измерений, то определить перечисленные соотношения для каждого из зарегистрированных кривых, а в итоговую таблицу внести средние значения и стандартное отклонение или ошибку среднего.
q Для опытных образцов с изменениями в значении Fv/Fm в 20-30 % построить и рассчитать параметры индукционных кривых флуоресценции (расчет по JIP-тесту). Данные представить в таблице и сравнить с контрольным образцом.
q Представить в удобной для восприятия форме результаты проведенных экспериментов и провести обсуждение их и сделать четкие выводы по полученным результатам; Отметить параметры флуоресценции, которые наиболее сильно изменяются при повреждении культуры в присутствии наночастиц.
Ниже для примера приведены результаты, полученные в опытах по исследованию действию ионов меди на параметры флуоресценции водорослей..
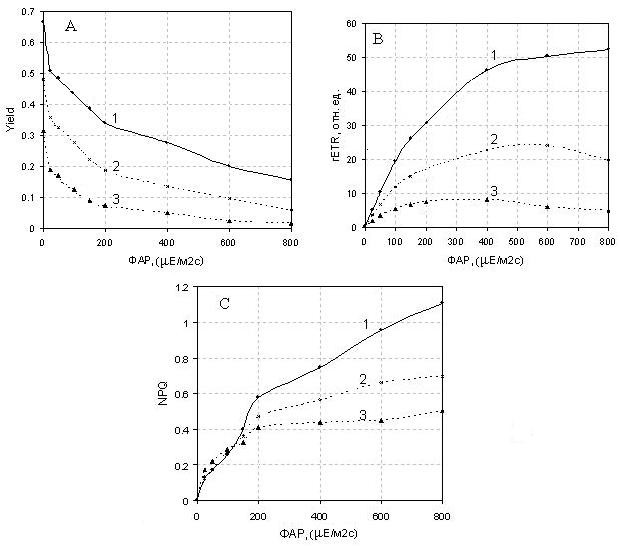
Рис. 6. Изменения параметров флуоресценции в зависимости от интенсивности действующего света в суспензии клеток водорослей Scenedesmus quadricauda под воздействием CuSO4. Время инкубации 1 сутки. A – квантовый выход фотохимического превращения поглощенной световой энергии в фотосистеме 2 как отношение Y= (Fm'-Ft)/Fm', B - относительная скорость нециклического электронного транспорта, C - нефотохимическое тушение NPQ=(Fm/Fm')-1. (1) - контроль, (2), (3) - после добавления CuSO4 в концентрациях 2·10-5М и 5·10-5М, соответственно.
Таблица. Изменения параметров световых зависимостей флуоресценции клеток C. reinhardtii в контроле и после CuSO4 (суточная инкубации)
| Параметры световых кривых | Контроль | 10-5М | 2·10-5М | 5·10-5М |
| Fv/Fm | 0.66 | 0.67 | 0.48 | 0.31 |
| NPQ 25 μE/м2с | 0.13 | 0.13 | 0.12 | 0.17 |
| NPQ 400 μE/м2с | 0.74 | 0.63 | 0.56 | 0.44 |
| rETRmax | 52.4 | 49.8 | 24.1 | 8.2 |
| α, угол наклона | 0.21 | 0.21 | 0.14 | 0.07 |
| Енас, rETR μE/м2с |
где, Fv/Fm – параметры проб в темноте; Y= (Fm'-Ft)/Fm' - фотохимическая активность ФС 2на свету;. нефотохимическое тушение NPQ; Параметры, описывающие зависимость электронного транспорта (rETR) от освещенности (световые кривые): коэффициент максимальной утилизации световой энергии, угол наклона световой кривой (α), максимальная относительная скорость нециклического транспорта электронов (rETR max) и насыщающая интенсивность света (Ен).
На рис.7. представлены исследования влияния солей CuSO4 на водоросли на новом приборе М-РЕА2. Это прибор позволяет одновременно оценить влияние загрязнений на работу ФС2 по индукции флуоресценции, ФС1 (по Р700) и процессы энергизации фотосинтетических мембран по индукции замедленной флуоресценции.
Кривая индукции быстрой флуоресценции O-I-D-P была описана выше. Она протекает за 1–3 с в зависимости от интенсивности света и других факторов. Более медленные изменения индукции флуоресценции P-S-M-T происходят за время от нескольких десятков секунд до нескольких минут. В типичной индукционной кривой ЗФ зеленого листа или водорослей при включении возбуждающего света различают несколько фазовых переходов. Эту кривую индукции можно описать наличием пиков I1–I6 (Рис. 7 Б). Пики максимумов кривой ЗФ в миллисекундном диапазоне (I1 и I2) совпадают с возрастанием Fj→Fi и Fi→Fp и отражают редокс-переходы на акцепторной стороне ФС2. Пик I1 совпадает с периодом максимальной скорости нарастания быстрой флуоресценции Fj→Fi. Поэтому образование I1 может быть обусловлено несколькими феноменами: фотохимическим тушением – накоплением определенных редокс-состояний, отвечающих за рекомбинацию зарядов и испускание квантов замедленной флуоресценции (т.н. высвечивающие состояния); нефотохимическим тушением – усилением ЗФ за счет электрического градиента на мембране.
I2 обычно наблюдается, когда быстрая флуоресценция возрастает в фазе Fi→Fp. В этот момент пул хинонов восстанавливается, происходит снижение восстановленности P700+ и величины трансмембранного электрического градиента. Быстрая и медленная фаза разделены минимумом D2. Этот минимум совпадает с максимумом быстрой флуоресценции Fp и с максимальной концентрацией восстановленного P700. Когда максимум Fp достигнут, пул хинонов восстановлен и акцепторная часть ФС1 неактивна. Наличие пиков ЗФ (I4 и I5) в секундном диапазоне может быть связано с фотоиндуцированным градиентом протонов и, с другой стороны, с активацией темновых реакций фотосинтеза. Провал D2 совпадает с максимальным уровнем Fp, что может быть связано с закрытием реакционных центров ФС2 при сверхвосстановленности пула хинонов. Максимум I4 предположительно связан с трансмембранным градиентом протонов, который увеличивает константу скорости излучательных переходов в РЦ ФС2. Появление максимума I6 связано с активацией цикла Кальвина и синтезом АТФ и НАДФH.
Одновременное измерение кинетической кривой ΔA810 на этом приборе показывает, что действие света у темноадаптированного объекта вызывает начальное окисление P700 (с максимумом накопления P700+ при t ≈ 30 мс), которое сменяется восстановлением P700+ до уровня с более высоким содержанием формы P700 по сравнению с исходным состоянием. При этом сигналы флуоресценции и ΔA810, отражающие восстановление QА и P700, достигают плато примерно синхронно. Параллельное накопление восстановленных форм P700 и QА отражает восстановление переносчиков на всем участке ЭТЦ между фотосистемами в связи с отсутствием оттока электронов из акцепторной части ФС1 в условиях, когда FNR инактивирована вследствие темновой инкубации. При длительности освещения ~10 c наблюдали вторую волну окисления P700, которую объясняют оттоком электронов от ФС1 при активации FNR и активацией цикла Кальвина. То есть одновременная регистрация индукции быстрой и замедленной флуоресценции, а также изменений Р700 позволяет следить за отдельными реакциями накопления восстановленных переносчиков между фотосистемами, включением ФС1 и кинетикой электрохимического градиента протонов на тиллакоидной мембране.
При регистрация на флуориметре М-РЕА2 образцов, обработанных CuSO4 наблюдалась уменьшение индукции быстрой флуоресценции, что указывает на ингибирование вклада фотохимической фазы J-I-P, и свидетельствует о нарушении фотосинтетического потока электронов в ФС2. Кроме того в присутствии CuSO4 р егистрируется низкая интенсивность замедленной флуоресценции, что свидетельствует об ингибировании энергизационных процессов на тиллакоидной мембране. Соли меди влияют также на окислительно-восстановительные процессы в фотосистеме1 по изменениям поглощении при длине волны 810.
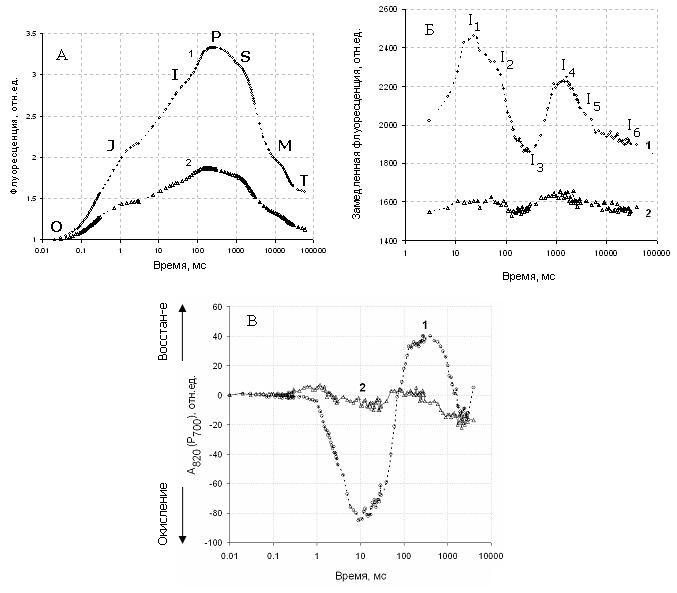
Рис.7. Индукционные кривые быстрой и замедленной флуоресценции хлорофилла и изменение поглощение при длине волны 820 нм, отражающее изменения пигмента ФС1-Р700 после включения освещения на контрольных образцах водорослей Scenedesmus quadricauda к контроле (1) и в присутствии CuSO4 (2). Интенсивность подсветки 1200 μЕ/м2с. Одновременные измерения всех параметров на приборе М-РЕА2.
 2015-02-27
2015-02-27 707
707








