Время нахождения (время жизни) взвешенных частиц в атмосфере зависит от их физико-химических свойств, метеорологических параметров, от высоты выбросов частиц в атмосферу, их размеров и т.д.
Основные процессы самоудаления аэрозолей из атмосферы:
1) осаждение частиц под действием сил тяжести;
2) осаждение на растениях;
3) включение их в элементы осадков, путем конденсации и вымывания дождем.
Быстрее всех осаждаются частицы с радиусом больше 10 мкм; с размером от 4 – 10 мкм с дымом распространяются на сотни километров, от 1 – 4 мкм осаждаются в течение года; с размером менее 1 мкм скорость осаждения ничтожно мала по сравнению с перемещением воздуха в атмосфере (не оседают вообще).
Срок жизни в атмосфере сернистого газа SO2 составляет от нескольких часов до нескольких суток. SO2 постепенно окисляется в SO3, который при взаимодействии с влагой воздуха образует серную кислоту. На скорость процесса окисления влияет солнечный свет, и мельчайшие частицы пыли, каталитически ускоряющие процесс окисления.
Наиболее активен процесс перехода SO2 в SO3 при длине волны 220 – 250 нм. На процесс окисления влияет также влажность. Например, при влажности воздуха 60 % концентрация аэрозоля серной кислоты в атмосферном воздухе 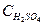 = 7,8 %, а при влажности 81 % -
= 7,8 %, а при влажности 81 % - 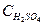 = 31 %.
= 31 %.
При сжигании органического топлива атмосферный запас СО2 возрастает на 0,7 % в год. В настоящее время средняя концентрация СО2 в атмосфере составляет примерно 0,033 % от первоначального (0,029 %).
Выбросы СО2 противопоставляются его усвоению растительностью, причем с повышением концентрации СО2 в атмосфере увеличивается интенсивность реакции фотосинтеза, то есть усиливается рост растений.
Реакция фотосинтеза: СО2 + Н2О + световая энергия → СН2О + О2
Формальдегид
К 2000 году концентрация СО2 удвоилась. Это ведет к повышению температуры на планете, за счет усиления поглощения в инфракрасной области спектра и уменьшение излучения энергии, теряемой в космосе.
С другой стороны, повышение запыленности атмосферы за счет вулканических извержений и деятельности человека снижает среднюю температуру планеты на 1 – 1,5 °С по сравнению с 1860 годом. Таким образом, влияние повышения содержания СО2 на климат затруднительно.
В связи с возрастающим количеством выбросов окислов азота от ТЭС, рассмотрим круговорот азота в атмосфере.
Атмосфера состоит из азота на 79 % в форме молекул N2. Растения же могут использовать только «фиксированный» азот, то есть азот, включенный в такие химические соединения, которые могут использовать растения и животные. В естественных условиях азот фиксируется почвенными организмами и некоторыми морскими организмами, некоторое количество фиксируется в атмосфере в природных процессах ионизации за счет воздействия космических лучей и электрических зарядов. В сельском хозяйстве для фиксации азота используют бобовые растения.
Время жизни окислов азота в атмосфере до 5 суток. Затем они вымываются атмосферными осадками, поступая в почву и водоемы. Таким образом, уже сейчас количество связанного азота за счет человеческой деятельности превышает количество связанного азота, получаемого естественным путем в природе.
Общее количество фиксированного азота без участия человечества составляет 58 млн. тонн в год, за счет действия человека примерно 64 млн. тонн в год, промышленного азота (транспорт и ТЭС) 20 млн. тонн в год.
Оксиды азота вызывают такое явление как фотохимический туман (смог), ухудшающее видимость и вредно влияющее на здоровье человека.
Фотохимическая реакция с двуокисью азота
NO2 + УФ = NO + O
 O + О2 = О3
O + О2 = О3
NO + O2 = NO3 вторичные реакции
NO3 + О2 = NO2 + O3
NO + O3 → NO2 + O2
В результате этих реакций количество NO2 в продуктах сгорания ТЭС увеличивается по мере движения дымового факела в атмосфере до 60 – 70% в зоне максимальных концентраций. Тогда как на выходе из дымовой трубы двуокись азота составляет 10 – 15 % всех окислов азота, содержащихся в дымовых газах, остальная часть 85 – 90 % NO. Это приводит к усилению отрицательного воздействия продуктов сгорания на природу, так как NO2 в 2 – 3 раза токсичнее по воздействию, чем NO.
Чем выше валентность оксида азота, тем он ядовитее.
Условиями, способствующими образованию фотохимического тумана (смога) является обилие солнечной радиации, температурная инверсия и малая скорость ветра. Вслед за низкими ночными концентрациями оксидантов наблюдается их значительное увеличение ранним утром, наивысшая концентрация в полдень и максимальная в течение всего светового дня.
На существование животного мира решающее воздействие оказывает кислород воздуха. Его содержание уменьшается в процессе дыхания и горения органического топлива, из-за сокращения зеленых массивов на земле. Снижение концентрации О2 связанно также с повышением концентрации СО2.
 2015-02-04
2015-02-04 648
648








