Химические реакции, как правило, не происходят путем непосредственного взаимодействия исходных молекул с прямым переходом их в молекулы продуктов реакции. В большинстве случаев реакции протекают в несколько стадий. Например, окисление ионов двухвалентного железа в кислом растворе молекулярным кислородом состоит из ряда стадий:
Fe2+ + O2 ® Fe3+ + O2-
O2- + H+ ® HO2·
Fe2+ + HO2· ® Fe3+ + HO2-
HO2- + H+ ® H2O2
H2O2 + Fe2+® Fe3+ + OH- + OH·
Fe2+ + OH· ® Fe3+ + OH-
OH- + H+ ® H2O.
Общее стехиометрическое уравнение реакции:
4Fe2+ + 4H+ + O2 ® 4Fe3+ + 2H2O.
Этот сложный путь оказывается, тем не менее, неизмеримо более выгодным, так как ни на одном из семи этапов не требуется встречи более чем двух частиц и ни на одном из этапов не требуется соударения одноименно заряженных частиц.
Совокупность стадий, из которых складывается химическая реакция, носит название механизма химической реакции.
Вещества, вступающие в процесс химического превращения, называются исходными. Вещества, образующиеся в процессе химического превращения и не претерпевающие в ходе этого процесса дальнейших химических изменений, называются продуктами реакции. Вещества, образующиеся в одних стадиях процесса химического превращения и расходующиеся в других стадиях этого же процесса, называют промежуточными веществами.
38. Скорость химической реакции и понятие лимитирующей стадии процесса.
Важнейшей количественной характеристикой процесса химического превращения является скорость процесса. Понятие скорости характеризует количество вещества, вступающего в реакцию в единицу времени. Это определение, однако, не совсем однозначно, так как в реакции принимают участие несколько веществ в качестве исходных, промежуточных и в качестве продуктов реакции. Поэтому строго можно говорить не о скорости химического процесса вообще, а о скорости по некоторому компоненту. Изменение количества этого компонента принято выражать в числе молей n. Таким образом, для гомофазного химического процесса, идущего при постоянном объеме, скоростью процесса по некоторому веществу называется изменение концентрации этого вещества в единицу времени. Пусть концентрация одного из реагирующих веществ в момент времени t1 равна С1, а в момент времени t2 равна С2. Тогда средняя скорость реакции (` V) за промежуток времени t2 – t1 равна 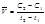 . (8.1) Поскольку концентрация вещества (исходного) в процессе реакции убывает, то C2 < C1 и разность C2 – C1 имеет отрицательный знак, т.е. C2 – C1 = -D С. Отсюда средняя скорость
. (8.1) Поскольку концентрация вещества (исходного) в процессе реакции убывает, то C2 < C1 и разность C2 – C1 имеет отрицательный знак, т.е. C2 – C1 = -D С. Отсюда средняя скорость 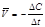 . (8.2) Переходя к бесконечно малым изменениям, можно отношение -
. (8.2) Переходя к бесконечно малым изменениям, можно отношение - 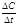 заменить на -
заменить на - 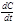 . В результате производная от концентрации по времени характеризует мгновенную (истинную) скорость химической реакции:
. В результате производная от концентрации по времени характеризует мгновенную (истинную) скорость химической реакции: 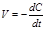 . (8.3) Скорость химической реакции всегда является величиной положительной, отношение же dC / dt может иметь и положительное, и отрицательное значение в зависимости от того, представляет С концентрацию одного из исходных веществ или одного из продуктов реакции. В первом случае dC / dt < 0, но так как скорость должна быть положительной, перед производной ставят минус; во втором случае dС / dt > 0, и чтобы скорость реакции имела положительное значение, берут производную со знаком плюс. В общем случае кинетическое уравнение имеет вид
. (8.3) Скорость химической реакции всегда является величиной положительной, отношение же dC / dt может иметь и положительное, и отрицательное значение в зависимости от того, представляет С концентрацию одного из исходных веществ или одного из продуктов реакции. В первом случае dC / dt < 0, но так как скорость должна быть положительной, перед производной ставят минус; во втором случае dС / dt > 0, и чтобы скорость реакции имела положительное значение, берут производную со знаком плюс. В общем случае кинетическое уравнение имеет вид 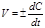 . (8.4) Однако необходимо учитывать, что измеренные по разным веществам скорости не равны, а пропорциональны одна другой. Например, в реакции синтеза аммиака N2 + 3H2 «2HN3 на каждый исчезающий моль N2 расходуется 3 моля H2 и образуется 2 моля аммиака. Соответствующие скорости реакции соотносятся как 1: 3: 2.Скорость реакции имеет размерность [концентр] × [время]-1. В химической кинетике концентрацию чаще всего выражают в моль/л, а время – в секундах. Отсюда скорость химической реакции выражается в моль× л-1 ×с-1. Если р-ция осуществляется путем последовательно протекающих стадий и одна из них требует значительно большего времени, чем остальные, то есть идет намного медленне, то такая стадия называется лимитирующей.
. (8.4) Однако необходимо учитывать, что измеренные по разным веществам скорости не равны, а пропорциональны одна другой. Например, в реакции синтеза аммиака N2 + 3H2 «2HN3 на каждый исчезающий моль N2 расходуется 3 моля H2 и образуется 2 моля аммиака. Соответствующие скорости реакции соотносятся как 1: 3: 2.Скорость реакции имеет размерность [концентр] × [время]-1. В химической кинетике концентрацию чаще всего выражают в моль/л, а время – в секундах. Отсюда скорость химической реакции выражается в моль× л-1 ×с-1. Если р-ция осуществляется путем последовательно протекающих стадий и одна из них требует значительно большего времени, чем остальные, то есть идет намного медленне, то такая стадия называется лимитирующей.
39. Порядок и молекулярность реакции. Применение порядка химической реакции для описания ее механизма.
Сумму порядков реакции по всем реагирующим веществам называют порядком реакции. Порядок реакции – величина формальная. Он может быть положительным, отрицательным, целым или дробным, а также нулевым числом. Порядок реакции определяется опытным путем, так как для большинства реакций порядки реакции по веществу не равнозначны стехиометрическим коэффициентам. Порядок реакции играет существенную роль при изучении и раскрытии механизма реакции. Он в значительной степени зависит от механизма реакции. Порядок реакции определяется опытным путем, и его нельзя предсказать заранее, даже для реакций формально похожих. а) Для определения порядка реакции часто используют способ подстановки. Он заключается в выборе уравнения кинетики реакции (нулевого, первого, второго порядков) при подстановке в которое экспериментальных данных получается постоянное значение константы скорости реакции. б) Существует и графический способ определения порядка реакции. Например, для реакции нулевого порядка скорость реакции не зависит от концентрации. Для реакции первого порядка прямолинейной является зависимость ln C от времени. Для реакции второго порядка линейной будет зависимость 1/ С от времени. в) Используется также определение зависимости от концентрации константы полупревращения и т.д. Молекулярность реакции определяется числом частиц, одновременно сталкивающихся и приводящих к химическим превращениям. Взаимодействие подобного рода носит название элементарного акта химического превращения. Различия между молекулярностью и порядком реакции заключаются в следующем: 1) молекулярность реакции имеет вполне определенный физический смысл, а порядок реакции – величина формальная; 2) порядок реакции может принимать любые значения, численные значения молекулярности ограничены тремя цифрами – 1, 2, 3; 3) порядок реакции можно использовать для характеристики любых реакций (как сложных так и простых), понятие «молекулярность» применимо только к элементарным актам химических превращений. 4) Порядок реакции – формальная величина, использующаяся для характеристики зависимости скорости реакции от концентрации реагирующих веществ.
 2015-02-04
2015-02-04 674
674








