Сильные электролиты в растворе практически полностью диссоциируют на ионы, т.е. истинное значение 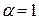 . Однако величина степени диссоциации, определяемая по физическим свойствам этих растворов (электропроводность, температура замерзания и т.д.) всегда меньше единицы. Кроме того, к растворам сильных электролитов неприменим закон действия масс в его обычной форме.
. Однако величина степени диссоциации, определяемая по физическим свойствам этих растворов (электропроводность, температура замерзания и т.д.) всегда меньше единицы. Кроме того, к растворам сильных электролитов неприменим закон действия масс в его обычной форме.
Наблюдаемые отклонения в свойствах растворов сильных электролитов связаны с сильным электростатическим взаимодействием ионов в растворе. Каждый ион окружён «ионной атмосферой» из ионов противоположного знака, которая влияет на его подвижность и вызывает отклонение свойств от ожидаемых величин.
Для характеристики растворов сильных электролитов вместо их истинной концентрации используют активность ( 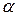 ),т.е. условную эффективную концентрацию в соответствии с которой они проявляют себя в химических и физических процессах.:
),т.е. условную эффективную концентрацию в соответствии с которой они проявляют себя в химических и физических процессах.:
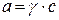
где 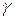 – коэффициент активности;
– коэффициент активности;
с – истинная концентрация.
Коэффициенты активности определяется экспериментально и приводится в таблицах. Для разбавленных растворов электролитов 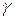 не зависит от природы иона и может быть рассчитан по формуле:
не зависит от природы иона и может быть рассчитан по формуле:
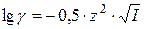
где I – ионная сила раствора, которая определяется по формуле:
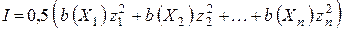
b (X) – моляльные концентрации ионов
z – заряды ионов.
Для предельно разбавленных растворов, в которых практически отсутствует взаимодействие между ионами, 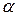 = с,и
= с,и 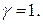
Лекция6 «Кислотно-основное равновесие в растворах».
Законы Вант-Гоффа и Рауля справедливы для идеальных растворов, т.е. таких, в которых нет химического взаимодействия между компонентами раствора, а также диссоциации или ассоциации молекул растворенного вещества. Опыт показал, что у растворов, проводящих электрический ток (электролиты), более высокое, чем по закону Вант-Гоффа, осмотическое давление, они кипят при более высокой и замерзают при более низкой температуре, чем это следует из закона Рауля. Такими свойствами обладают растворы солей, кислот и оснований.
Электролиты – вещества, которые при растворении распадаются на ионы.
Различают слабые и сильные электролиты. Сильные в растворе практически полностью распадаются на ионы.
Слабые электролиты в растворе распадаются на ионы частично.
Вант – Гофф пришел к выводу, что в отношении осмотического давления растворы электролитов ведут себя так, как будто они содержат больше частиц, чем это следует из аналитической концентрации. Исходя из этого, Вант – Гофф внес в уравнение для растворов электролитов поправку, получившую название коэффициента Вант-Гоффа или изотонического коэффициента (i):
π= iсΤR
Он показывает, во сколько раз наблюдаемое осмотическое давление (π) раствора больше теоретически вычисленного для раствора неэлетролита:
π = 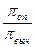
Отсюда следует:
i = 
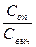 =
= 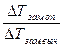 =
= 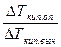
Таким образом, коэффициент можно найти, если измерить осмотическое давление, например криоскопическим методом. Коэффициент Вант-Гоффа для неэлектролитов равен 1, а для электролитов он больше единицы. Значение коэффициента растет по мере разбавления электролита. Для растворов, в которых имеет место ассоциация молекул растворенного вещества, коэффициент бывает меньше единицы.
Причину отклонения от законов Вант-Гоффа и Рауля в растворах электролитов впервые разъяснил С. Аррениус в своей теории электролитической диссоциации. Она основывается на трех постулатах:
1. Электролиты в растворах диссоциируют на ионы, т.е. число частиц в растворе увеличивается. Это влияет на осмотическое давление, температуры кипения и замерзания растворов, т.е. свойства электролитов определяются суммой концентрации частиц – ионов и недиссоциированных молекул.
2. Электролиты при растворении диссоциируют на ионы не полностью. Величина степени электролитической диссоциации зависит от природы растворенного вещества и растворителя, а также от концентрации и температуры раствора.
3. Силы взаимодействия между ионами отсутствуют и растворы электролитов ведут себя подобно идеальным газовым системам.
Это позволило объяснить многие свойства растворов. Аррениус показал, что степень диссоциации связана с коэффициентом Вант-Гоффа.
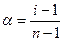
Но теория Аррениуса несовершенна. Дальнейшие исследования показали, что она приложима только к разбавленным растворам слабых электролитов. Это связано с тем, что он не учитывал взаимодействие частиц растворенного вещества между собой и с молекулами растворителя.
Эти противоречия в значительной мере устранены благодаря теории сильных электролитов.
В 1923 г. она создана Дебайем и Хюккелем, большой вклад внесли Коновалов Д.П., Каблуков И.А., Кистяков В.А. и др. Согласно это теории в растворах сильных электролитов действуют электростатические силы притяжения между разноименными ионами и силы отталкивания между одноименными. Вокруг каждого иона образуется ионная сфера, состоящая из ионов противоположного знака. Все это обусловливает довольно сложные взаимоотношения между компонентами раствора, которые не могут не сказаться на его свойствах.
Исходя из того, что сильные электролиты полностью диссоциированны, можно было ожидать, что коэффициент Вант-Гоффа для электролита, диссоциирующего, например, на два иона, должен равняться двум не только в разбавленных, но и в достаточно концентрированных растворах. Коэффициент i в растворах сильных электролитов в значительной степени зависит от концентрации электролита, уменьшаясь с увеличением концентрации раствора. Такая зависимость коэффициента от концентрации в растворах объясняется взаимодействием ионов между собой.
Межионное взаимодействие, а также сольватация ионов уменьшают не только абсолютную скорость их движения, но и осмотическое давление растворов, величину понижения давления пара над ним и т.д. Создается впечатление, что в растворе находится меньше ионов, чем на самом деле. Поэтому величина α является не истинной, а кажущейся степенью электролитической диссоциации сильного электролита.
В слабых электролитах, растворы которых содержат относительно малое количество ионов, взаимодействие последних сравнительно невелико. Кажущаяся степень диссоциации для них практически отвечает истинному значению.
Поэтому для термодинамических расчетов свойств растворов сильных электролитов Льюисом введена активность электролита.
Активность определяется как величина, подстановка которой вместо концентрации в термодинамические уравнения, действительные для идеальных систем, делает их применимыми к рассматриваемым растворам.
Активности отличаются от концентраций только тем. что в них входят силы взаимодействия, существующие в растворах и не зависящие от природы растворенных частиц, а также от их концентрации. Поэтому активность можно представить как произведение концентрации на некоторый переменный фактор, называемый коэффициентом активности:
а= f С
Коэффициенты активности можно найти, сравнивая аналитические концентрации с теми величинами, которые следует подставить в уравнение для растворов электролитов, чтобы получить полное соответствие с данными опыта. Обычно их определяют экспериментально по величине осмотического давления, по понижению температуры замерзания и повышению температуры кипения раствора.
Коэффициент активности, как правило, бывает меньше единицы, он становится равным единице при очень большом разбавлении раствора, когда силы взаимодействия между ионами приближаются к нулю. В этом случае а=С, т.е. движение ионов в этом растворе не стеснено.
При очень больших концентрациях некоторых электролитов f начинает расти, что объясняется недостатком молекул воды для гидратации всех ионов. Ионы частично или полностью лишенные гидратной оболочки, особенно легко подвижны. Активность оказывается больше действительной концентрации частиц, а коэффициент активности становится больше единицы.
Для характеристики зависимости активности иона от концентрации всех находящихся в растворе ионов Льюис ввел понятие об ионной силе раствора электролита. Ионной силой раствора электролита называется величина (I), измеряемая полусуммой произведения концентрации (С) каждого из присутствующих в растворе ионов на квадрат их валентности (z):
I = ½(z21С1 + z22С2 +…)
Теория сильных электролитов позволяет определить и рассчитать ряд важных свойств растворов электролитов, но удовлетворительное совпадение теории с практикой наблюдается в очень разбавленных растворах при концентрациях меньше 0,01М.
Вода является средой, в которой протекают самые разнообразные химические процессы. Она обладает хорошей растворяющей способностью и вызывает электролитическую диссоциацию многих растворенных в ней веществ. Более того, химически чистая вода сама является слабым электролитом и частично диссоциирует на ионы.
Н2О ↔ ОН- + Н+
Ионы водорода легко гидролизуются, образуя ионы гидроксония Н3О+.
Тщательно очищенная вода, как показал Кольрауш, обладает незначительной электрической проводимостью. Константа электролитической диссоциации воды равна:
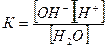
К=1,8•10-16, α = 1,7•10-9, поэтому концентрацию недиссоциированным молекул можно приравнять к общему количеству воды и считать ее постоянной величиной, т.е [Н2О] = const.
Тогда К = [ОН-][Н+] = ионное произведение воды.
Зная константу диссоциации, легко вычислить концентрацию водородных и гидроксильных ионов воды. В абсолютно чистой воде количество ОН- и Н+ одинаково. В любом водном растворе при постоянной температуре произведение концентраций ионов водорода и гидроксил ионов сохраняет определенное, постоянное значение, равное ионному произведению воды. Численное значение ионного произведения воды не зависит от природы растворенного вещества, поскольку концентрации водородных ионов и гидроксильных ионов величины сопряженные.
Для чистой воды [ОН-]=[Н+] = 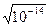 =10-7 моль/л. т.е. среда нейтральная. На практике неудобно характеризовать кислотность или щелочность растворов числами с отрицательными показателями степени неудобно. Поэтому для выражения концентраций Соренсен в 1920 г ввел понятие водородный показатель рН.
=10-7 моль/л. т.е. среда нейтральная. На практике неудобно характеризовать кислотность или щелочность растворов числами с отрицательными показателями степени неудобно. Поэтому для выражения концентраций Соренсен в 1920 г ввел понятие водородный показатель рН.
Величина рН это отрицательный десятичный логарифм числа, выражающего концентрацию ионов воды в этом растворе (моль/л).
рН = -lg[Н+], отсюда рОН + рН =14
Определение рН раствора сводится к определению концентрации ионов водорода в растворе. Рассмотрим растворы сильных кислот и оснований., т.к их можно считать практически полностью диссоциированными в воде.
При диссоциации кислоты ионы водорода с одной стороны возникают при диссоциации кислоты, а с другой стороны и при диссоциации воды. Но последняя диссоциирует незначительно, поэтому этим количеством ионов можно пренебречь. Учитываются только ионы образованные кислотой, а ее диссоциация считается полной. Тогда: [Н+] = [кислоты] = С моль/л
рН = -lg[Н+] = -lg С
Рассмотрим теперь диссоциацию слабой кислоты в водном растворе. Например, слабая уксусная кислота диссоциирует по уравнению:
СН3СООН ↔ СН3СОО- + Н+
Известно, что в данном случае диссоциация протекает частично. Расчет рН заключается в определении концентрации ионов водорода в растворе. здесь так же можно пренебречь концентрацией ионов водорода, возникающей при диссоциации воды. Тогда будет справедливо соотношение:
[СН3СОО-]=[Н+]
В соответствии с законом действующих масс константа равновесия реакции диссоциации уксусной кислоты:
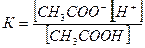
Она устанавливает соотношение между концентрациями различных химических соединений при равновесии в растворе, т.е. ионов водорода, ацетат ионов и недиссоциированных молекул уксусной кислоты.
Константа равновесия для случаев диссоциации молекул получила название константы электролитической диссоциации. Эта константа у слабых электролитов не зависит от концентрации раствора (зависит только от температуры). Константа электролитической диссоциации является характеристикой силы электролита. Чем константа диссоциации больше, тем сильнее электролит. Константа диссоциации имеет постоянное значение (при данной температуре) только для слабых электролитов. Такого постоянства для сильных электролитов нет.
Можно вывести уравнение, которое связывает константу электролитической диссоциации электролита со степенью его диссоциации и с концентрацией раствора.
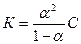
Эта формула является математическим выражением закона разбавления. Он впервые был выведен В. Оствальдом. Применим только к слабым электролитам, если пренебречь величиной α, которая очень мала, то:
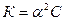
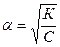 [Н+] =
[Н+] = 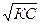
Формула позволят вычислить степень электролитической диссоциации слабой кислоты или основания, когда константа известна.
Для сильных электролитов закон разведения Оствальда неприменим, т.к. для них величина К с увеличением концентрации непрерывно возрастает.
При растворении некоторых солей в воде происходит нарушение равновесия диссоциации воды. Например, раствор карбоната натрия – щелочной, хлорида алюминия – кислый, хлорида натрия – нейтральный. Это связано с гидролизом солей. Гидролиз необходимо учитывать в случаях, когда необходимо сохранить в системе постоянство рН.
Как показывает опыт, разбавленные растворы сильных кислот или оснований, обладают слабокислой или слабощелочной средой, характеризующейся непостоянством рН. Однако смесь, например, уксусной кислоты и ее натриевой соли обладает способностью сохранять постоянство рН. Можно к этой смеси добавить небольшое количество кислоты или щелочи, а так же разбавить ее, но рН раствора при этом почти не изменится.
Лекция 7 «Электрохимия. Электропроводность растворов электролитов».
Гальваническими элементами называют устройства, в которых химическая энергия окислительно-восстановительных процессов преобразуется в электрическую.
Гальванический элемент состоит из двух электродов (катода и анода), погруженных в растворы своих солей. Электроды пространственно отделены друг от друга и соединены между собой металлическим проводником с включенным в него гальванометром. Электролиты соединяются через электрический ключ для обмена анионами.
Устройство медно-цинкового гальванического элемента
( элемента Якоби-Даниэля)
Гальванический элемент Якоби-Даниэля представляет собой два металлических электрода (пластинки цинка и меди) соединенных с гальванометром, погруженные в два отдельных стакана с растворами их собственных солей (1н.раствор ZnSО4 и 1н.раствор CuSО4), соединенных электролитическим ключом (изогнутая стеклянная трубка, заполненная насыщенным раствором хлорида калия в смеси с агар - агаром).
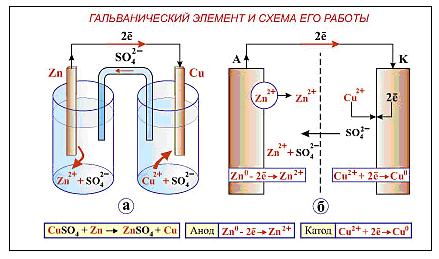
Рисунок 1- Гальванический элемент Якоби-Даниэля
При замыкании электродов через внешнюю цепь, на цинковом электроде пойдет процесс окисления цинка: Zn0 – 2е ® Zn2+.Электроны, образующиеся на цинковом электроде переходят по наружному проводнику к медному электроду, где будут участвовать в процессе восстановления ионов меди:
Cu2+ +2е ® Cu0
Образующиеся ионы Zn2+переходят в раствор и служат переносчиками электрического тока. Суммарная химическая реакция выражается следующей схемой: Zn0 + Cu2+SO4 = Cu0 + Zn2+SO4
Необходимо уметь записывать «Формулу гальванического элемента».
Сначала записывается символ металла (анод), затем ставится черта и пишется формула соли металла с меньшим значением потенциала, образующего анод. Потом, через двойную черту – формулу соли металла, образующего катод, и, через одинарную черту, символ металла, образующего катод.
Например, формула медно-цинкового гальванического элемента (элемента Якоби –Даниэля) будет иметь следующий вид:
-Zn/ZnSO4//CuSO4/Cu+; или в ионной форме -Zn/Zn2+//Cu2+/Cu+
(одиночные вертикальные линии изображают границу металл-раствор, а двойная линия – границу между растворами электролитов).
Важнейшей количественной характеристикой обратимого гальванического элемента является его Э.Д.С. (электродвижущая сила), которую рассчитывают по формуле:
Э.Д.С. = Ек. – Еа., где Ек. и Еа. – электродные потенциалы катода и анода. Их стандартные величины даны в справочниках.
Стандартные электродные потенциалы – это Э.Д.С. металла, измеренная при н.у. (Т = 298К, Р – 1,01· 105 Па) при опускании пластины этого металла, погруженной в раствор его соли, содержащей 1 моль ионов металла на 100г и соединенной с водородным электродом.
Таблица 2 - Стандартные электродные потенциалы при 25o С.
| Электрод | Электродная реакция | Eo, В |
| Li+/Li | Li+ + e = Li | -3.045 |
| K+/K | K+ + e = K | -2.925 |
| Ba2+/Ba | Ba2+ + 2e = Ba | -2.906 |
| Ca2+/Ca | Ca2+ + 2e = Ca | -2.866 |
| Na+/Na | Na+ + e = Na | -2.714 |
| La3+/La | La3+ + 3e = La | -2.522 |
| Mg2+/Mg | Mg2+ + 2e = Mg | -2.363 |
| Be2+/Be | Be2+ + 2e = Be | -1.847 |
| A13+/A1 | Al3+ + 3e = Al | -1.662 |
| Ti2+/Ti | Ti2+ + 2e = Ti | -1.628 |
| Zr4+/Zr | Zr4+ + 4e = Zr | -1.529 |
| V2+/V | V2+ + 2e = V | -1.186 |
| Mn2+/Mn | Mn2+ + 2e = Mn | -1.180 |
| WO42-/W | WO42- + 4H2O + 6e = W + 8OH- | -1.05 |
| Se2-/Se | Se + 2e = Se2- | -0.77 |
| Zn2+/Zn | Zn2+ + 2e = Zn | -0.763 |
| Cr3+/Cr | Cr3+ + 3e = Cr | -0.744 |
| Ga3+/Ga | Ga3+ + 3e = Ga | -0.529 |
| S2-/S | S + 2e = S2- | -0.51 |
| Fe2+/Fe | Fe2+ + 2e = Fe | -0.440 |
| Cr3+,Cr2+/Pt | Cr3+ + e = Cr2+ | -0.408 |
| Cd2+/Cd | Cd2+ + 2e = Cd | -0.403 |
| Ti3+, Ti2+/Pt | Ti3+ + e = Ti2+ | -0.369 |
| Tl+/Tl | Tl+ + e = Tl | -0.3363 |
| Co2+/Co | Co2+ + 2e = Co | -0.277 |
| Ni2+/Ni | Ni2+ + 2e = Ni | -0.250 |
| Mo3+/Mo | Mo3+ + 3e = Mo | -0.20 |
| Sn2+/Sn | Sn2+ + 2e = Sn | -0.136 |
| Pb2+/Pb | Pb2+ + 2e = Pb | -0.126 |
| Ti4+, Ti3+/Pt | Ti4+ +e = Ti3+ | -0.04 |
| D+/D2, Pt | D+ + e = 1/2 D2 | -0.0034 |
| H+/H2, Pt | H+ + e = 1/2 H2 | 0.000 |
| Ge2+/Ge | Ge2+ + 2e = Ge | +0.01 |
| Br-/AgBr/Ag | AgBr + e = Ag + Br- | +0.0732 |
| Sn4+, Sn2+/Pt | Sn4+ + 2e = Sn2+ | +0.15 |
| Cu2+, Cu+/Pt | Cu2+ + e = Cu+ | +0.153 |
| Cu2+/Cu | Cu2+ + 2e = Cu | +0.337 |
| Fe(CN)64-, Fe(CN)63-/Pt | Fe(CN)63- + e = Fe(CN)64- | +0.36 |
| OH-/O2, Pt | l/2 O2 + H2O + 2e = 2OH- | +0.401 |
| Cu+/Cu | Cu+ + e = Cu | +0.521 |
| J-/J2, Pt | J2 + 2e = 2J- | +0.5355 |
| Te4+/Te | Te4+ + 4e = Te | +0.56 |
| MnO4-, MnO42-/Pt | MnO4- + e = MnO42- | +0.564 |
| Rh2+/Rh | Rh2+/Rh | +0.60 |
| Fe3+, Fe2+/Pt | Fe3+ + e = Fe2+ | +0.771 |
| Hg22+/Hg | Hg22+ + 2e = 2Hg | +0.788 |
| Ag+/Ag | Ag+ + e = Ag | +0.7991 |
| Hg2+/Hg | Hg2+ + 2e = Hg | +0.854 |
| Hg2+, Hg+/Pt | Hg2+ + e = Hg+ | +0.91 |
| Pd2+/Pd | Pd2+ + 2e = Pd | +0.987 |
| Br-/Br2, Pt | Br2 + 2e = 2Br- | +1.0652 |
| Pt2+/Pt | Pt2+ + 2e = Pt | +1.2 |
| Mn2+, H+/MnO2, Pt | MnO2 + 4H+ + 2e = Mn2+ + 2H2O | +1.23 |
| Cr3+, Cr2O72-, H+/Pt | Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O | +1.33 |
| Tl3+, Tl+/Pt | Tl3+ + 2e = Tl+ | +1.25 |
| Cl-/Cl2, Pt | Cl2 + 2e = 2Cl- | +1.3595 |
| Pb2+, H+/PbO2, Pt | PbO2 + 4H+ + 2e = Pb2+ + 2H2O | +1.455 |
| Au3+/Au | Au3+ + 3e = Au | +1.498 |
| MnO4-, H+/MnO2, Pt | MnO4- + 4H+ + 3e = MnO2 + 2H2O | +1.695 |
| Ce4+, Ce3+/Pt | Ce4+ + e = Ce3+ | +1.61 |
| SO42-,H+/PbSO4, PbO2, Pb | PbO2 + SO42- + 4H+ + 2e = PbSO4 + 2H2O | +1.682 |
| Au+/Au | Au+ + e = Au | +1.691 |
| H-/H2, Pt | H2 + 2e = 2H- | +2.2 |
| F-/F2, Pt | F2 + 2e = 2F- | +2.87 |
ЭДС элемента связана с  G протекающей в элементе реакции:
G протекающей в элементе реакции:
 G = - nFE.
G = - nFE.
Зная стандартную ЭДС, можно рассчитать константу равновесия протекающей в элементе реакции:
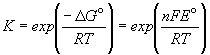 .
.
Константа равновесия реакции, протекающей в элементе Даниэля, равна
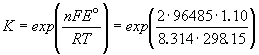 = 1.54. 1037.
= 1.54. 1037.
Зная температурный коэффициент ЭДС 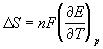 , можно найти другие термодинамические функции:
, можно найти другие термодинамические функции:
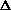 S =
S = 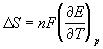
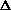 H =
H = 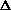 G + T
G + T 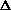 S = - nFE +
S = - nFE + 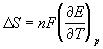 .
.
 2015-02-04
2015-02-04 3699
3699
