Химическая кинетика изучает скорость протекания химических процессов, зависимость скорости от различных факторов, а также пути протекания химических реакций. Знание законов химической кинетики необходимо при разработке химической аппаратуры, для интенсификации и автоматизации промышленных процессов.
Различают реакции гомогенные и гетерогенные. Гомогенные реакции – это реакции, протекающие в однородной системе. Гетерогенные реакции протекают в системе, где исходные вещества, продукты реакции и примеси находятся в различных фазах, причем химические превращения идут не по всему объему, а на границе раздела фаз.
Различают простые (элементарные) химические реакции, протекающие в одну стадию, и сложные реакции, протекающие через несколько стадий (т.е. являются совокупностью простых реакций)
Все кинетические реакции различают по молекулярности и порядку реакции. Молекулярность реакции определяется числом частиц, участвующих в элементарном акте химического взаимодействия.
Мономолекулярные реакции идут с превращением одного вида молекул, и в каждой единичной реакции участвует только одна молекула: изомеризация, диссоциация и др. (стехиометрический коэффициент равен единице):
А → В
К таким реакциям относятся реакции термического разложения веществ, процессы радиоактивного распада атомов, а также некоторые реакции изомеризации.
В бимолекулярных реакциях участвуют две молекулы одного вида:
2А → В
или два различных вида молекул:
А + В → С + D
Одновременная встреча в элементарном акте взаимодействия трех молекул случается крайне редко. Реакции более высокой молекулярности неизвестны. В тех случаях, когда из химического уравнения следует, что в реакции участвует большее число молекул, процесс на самом деле происходит более сложным путем – через две и большее число промежуточных стадий моно- или бимолекулярных реакций.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Тем не менее, никакой четко определенной взаимосвязи между понятиями молекулярности и порядка реакции не существует. Порядок реакции характеризует кинетическое уравнение реакции, а молекулярность – механизм реакции.
Порядок химической реакции равен суммепоказателей степени концентраций реагентов в кинетическом уравнении реакции.Например, скорость реакции выражена уравнением:
υ = kсbсd
тогда порядок реакции равен (b+d).
Реакции нулевого порядка характеризуются следующим кинетическим уравнением:
υ = kс0= k
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентрации реагирующих веществ. Это характерно для многих гетерогенных реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
Реакции первого порядка характеризуются следующим кинетическим уравнением:
υ = kс
Например, разложение пероксида водорода. Скорости таких реакций меняются в соответствии с таким простым законом: «В каждую единицу времени подвергается превращению одна и та же дробная часть оставшегося в наличии числа молекул».
Реакции первого порядка протекают в соответствии с уравнением:
К= 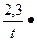 lg
lg 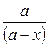 , где
, где
х – количество прореагировавшего вещества, за время t
t – время реакции,
К – константа скорости,
а – начальная концентрация вещества,
(а-х) – количество вещества в данный момент времени.
Скорость таких реакций не зависит от объема системы.
Если «К», подсчитанное по этой формуле для различных моментов времени «t», остается постоянным (в пределах ошибки опыта), то изучаемая реакция является реакцией первого порядка.
Реакции второго порядка – это, например, образование йодистого водорода из водорода и йода. Если начальные концентрации реагирующих веществ одинаковы, то реакции второго порядка протекают в соответствии с уравнением:
К= 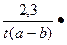 lg
lg 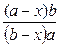 , где
, где
х – количество прореагировавшего вещества, за время t
а и b – начальные концентрации веществ.
Если «К», подсчитанное по этой формуле для различных моментов времени «t», остается постоянным (в пределах ошибки опыта), то изучаемая реакция является реакцией второго порядка.
В каждом конкретном случае порядок реакции устанавливается подстановкой экспериментальных данных в кинетическое уравнение константы скорости.
Сущность изучаемой реакции. Пероксид водорода самопроизвольно Разлагается по уравнению:
Н2О2 = Н2О + 1/2О2
Некоторые вещества, например, соединения хрома, активированный уголь, фермент каталаза значительно ускоряют эту реакцию. В выполняемой работе в качестве катализатора рекомендуется использовать активированный уголь.
 2015-02-04
2015-02-04 970
970








