Водородсодержащие группы атомов (где атом водорода соединен с атомом фтора, кислорода или азота, реже: хлора, серы или других неметаллов) часто образуют устойчивую химическую связь с электроотрицательными атомами, входящими в состав другой или той же самой молекулы. Такой вид химической связи получил название водородной связи. Это частный случай Ван-дер-ваальсовых сил.
Ковалентные связи H-O, H-F, H-N являются сильно полярными, за счет чего на атоме водорода скапливается избыточный положительный заряд, а на противоположных полюсах - избыточный отрицательный заряд. Между разноименно заряженными полюсами возникают силы электростатического притяжения - водородные связи. Водородный вид химической связи может быть как межмолекулярным, так и внутримолекулярным. Энергия водородной связи примерно в десять раз меньше энергии обычной ковалентной связи, но тем не менее водородные связи играют большую роль во многих физико-химических и биологических процессах. В частности, молекулы ДНК представляют собой двойные спирали, в которых две цепи нуклеотидов связаны между собой водородными связями.
Одним из признаков этого вида химической связи может служить расстояние между атомом водорода и другим атомом, ее образующим. Оно должно быть меньше, чем сумма радиусов этих атомов. Чаще встречаются несимметричные водородные связи, в которых расстояние Н... В больше, чем А-В. Однако в редких случаях (фтороводород, некоторые карбоновые кислоты) водородная связь является симметричной. Наиболее сильные водородные связи образуются с участием атомов фтора. В симметричном ионе [F-H-F]- энергия водородной связи равна 155 кДж/моль и сопоставима с энергией другого вида связи - ковалентной связью. Энергия водородная связи между молекулами воды уже заметно меньше (25 кДж/моль).
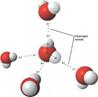
Рис. 2. Водородная связь между молекулами воды
Всякое вещество состоит из большого числа мельчайших частичек — молекул. Каждая молекула, в свою очередь, состоит из сравнительно небольшого числа атомов. По взаимному расположению атомов или молекул твердые тела подразделяют на кристаллические и аморфные.
Кристаллическими называются тела, в которых атомы и молекулы расположены в правильном геометрическом порядке, а аморфными (стеклообразными) — тела, в которых атомы и молекулы расположены беспорядочно.
Твердые тела имеют кристаллическое или аморфное строение. Твердое кристаллическое тело представляет собой совокупность множества произвольно расположенных и взаимно связанных кристаллов.
Кристалл есть твердое вещество (здесь не рассматривается класс жидких кристаллов), обладающее трехмерной периодической атомной структурой и при равновесных условиях образования имеющее естественную форму правильных симметричных многогранников. Следовательно, кристаллическое строение характеризуется правильным, закономерным расположением частиц (атомов, молекул) в пространстве.
Кристаллическая решетка представляет собой пространственную сетку, в узлах которой располагаются частицы (атомы, ионы или молекулы), образующие кристалл.
В основе кристаллической решетки лежит элементарная кристаллическая ячейка, представляющая собой параллелепипед с характерным для данной решетки расположением атомов
Важнейшим геометрическим свойством кристаллов, кристаллических решеток и их элементарных ячеек является симметрия по отношению к определенным направлениям (осям) и плоскостям. Число возможных видов симметрии ограничено.
Французский кристаллограф О. Браве в 1848 г. положил начало геометрической теории структуры кристаллов и показал, что в зависимости от соотношения величины и взаимной ориентации ребер элементарной кристаллической ячейки может существовать 14 типов кристаллических решеток (они получили название решеток Браве).
Различают примитивные (простые), базоцентрированные, объемноцентрированные и гранецентрированные решётки Браве. Если узлы кристаллической решетки расположены только в вершинах параллелепипеда, представляющего собой элементарную ячейку, то такая решетка называется примитивной или простой. Если, кроме того, имеются узлы в центре оснований параллелепипеда, то решетка называется базоцентрированной, если есть узел в месте пересечения пространственных диагоналей – решетка называется объемноцентрированной, а если имеются узлы в центре всех боковых граней – гранецентрированной.
Для определения атомных плоскостей в пространстве, т.е плоскостей, проходящих через атомы, пользуются индексами. NKL – индексы Мюллера, они представляют собой 3 целых рациональных числа, по величине равных обратным отрезкам, отсекаемых данными плоскостями на осях координат. Единицы длины вдоль этих осей выбирают равными длинам ребер элементарных ячеек.
 2015-02-18
2015-02-18 799
799








