Согласно этой теории, образование многих комплексных соединений в первом приближении можно объяснить электростатическим притяжением между центральным катионом металла и противоположно заряженными анионами или полярными молекулами лигандов. При достаточном их сближении в пространстве в формирующемся комплексном ионе наряду с силами притяжения начинают действовать силы электростатического отталкивания, особенно между одноименно заряженными или, в случае полярных молекул, одинаково ориентированными лигандами. В результате возникает правильное геометрическое расположение лигандов и образуется устойчивая структура, с минимальной потенциальной энергией. Количественные расчеты В. Косселя и А. Магнуса (1916-1922 г.г.) подтверждают правомочность такой модели, показывают прямую зависимость координационного числа от заряда центрального иона. Однако простая электростатическая теория не в состоянии объяснить своеобразие реакционной способности комплексных соединений, их магнитные свойства, окраску, избирательность (специфичность) комплексообразования, поскольку не принимает во внимание природу центрального иона и лигандов, особенности строения их электронных оболочек, взаимное влияние ионов друг на друга. Более полно и точно образование химических связей, свойства и организацию комплексных соединений объясняют теории, основанные на квантовомеханических представлениях о строении атомов и молекул: метод валентных связей и метод молекулярных орбиталей.
1.2.2. Метод валентных связей
Метод валентных связей к комплексным соединениям впервые применил американский химик Л. Полинг в 30-х годах прошлого столетия. Полинг исходил их следующих допущений:
- для образования ковалентных связей с орбиталями лиганда центральный атом или ион металла должен содержать некоторое число пустых (вакантных) орбиталей, определяющих его координационную валентность;
- ковалентные связи образуются перекрыванием вакантных орбиталей атома (иона) металла с заполненными орбиталями донорного иона (лиганда). Донорный ион обязан иметь для этого, по крайней мере, одну неподеленную пару электронов:
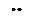
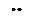
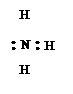
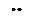
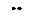
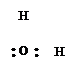
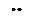
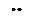
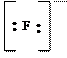
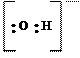
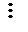
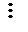
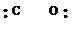
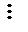  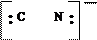 |
молекула молекула молекула ион ион ион
воды аммиака монооксида гидроксила циана фтора углерода
Формирующиеся в комплексах σ-связи являются двухэлектронными и двухцентровыми, а образование их протекает по донорно-акцепторному механизму;
- чем больше электронные облака перекрывают друг друга, тем более прочной является возникающая химическая связь. Для удовлетворения этого критерия необходимо, чтобы исходные атомные орбитали были гибридизованы и формировали новую систему перекрывающихся эквивалентных орбиталей с определенной направленностью в пространстве.
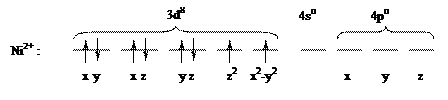 |
Рассмотрим с позиции метода валентных связей образование химических связей между комплексообразователем и лигандами на конкретных примерах. В комплексной соли K2[NiCl4] конфигурация валентной оболочки иона никеля Ni2+ в основном состоянии описывается формулой 3d84s04p0 и может быть представлена в виде диаграммы заполнения ячеек:
Согласно диаграммы, Ni2+ имеет четыре вакантные орбитали: 4s, 4px, 4py, 4pz. Ионы хлора на внешней оболочке содержат свободные неподеленные пары электронов - 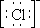 . Под действием электрического поля ионов хлора ион никеля (II) из основного переходит в возбужденное состояние с гибридизацией одной 4s и трех 4p-орбиталей:
. Под действием электрического поля ионов хлора ион никеля (II) из основного переходит в возбужденное состояние с гибридизацией одной 4s и трех 4p-орбиталей:
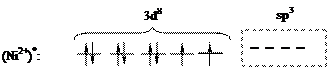 |
Последующее перекрывание вакантных sp3-атомных орбиталей возбужденного иона Ni2+ c двухэлектронными sp3-атомными орбиталями ионов хлора приводит к обобщению четырех неподеленных электронных пар хлора и формированию комплексного иона [NiCl4]2–, с тетраэдрической ориентацией лигандов (тетраэдрическая координация):
 |
Возникают четыре равноценные двухэлектронные σ-связи Ni2+ – Cl–, аналогичные по свойствам одинарным σ-связям в простых бинарных соединениях (рис. 1.2):

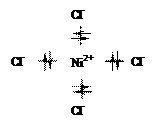
Или
Рис. 1.2. Комплексный ион [NiCl4]2–
Суммарную реакцию образования комплексного иона можно записать:
 Ni2+ + 4 Сl– [NiCl4]2–.
Ni2+ + 4 Сl– [NiCl4]2–.
Химические связи, возникающие при комплексообразовании за счет неподеленной электронной пары одного из взаимодействующих атомов (ионов) и свободной орбитали другого атома (иона), называются донорно-акцепторными координационными связями. Нейтральные молекулы или ионы, отдающие свои неподеленные пары электронов в «общее пользование», называются донорными; атомы (ионы)-комплексообразователи, предоставляющие свободные орбитали для размещения этих электронов – акцепторными.
|
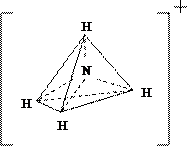 Идентичные химические связи, с тетраэдрической направленностью sp3-гибридных орбиталей, возникают в ионе NH4+, при взаимодействии молекул аммиака с протоном H+; ионе BF4–, при взаимодействии BF3 с анионом F– (рис. 1.3):
Идентичные химические связи, с тетраэдрической направленностью sp3-гибридных орбиталей, возникают в ионе NH4+, при взаимодействии молекул аммиака с протоном H+; ионе BF4–, при взаимодействии BF3 с анионом F– (рис. 1.3): или 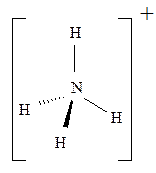
Рис. 1.3. Тетраэдрическая конфигурация атома азота в ионе NH4+
Изложенное позволяет дать общее определение комплексным соединениям. Комплексными называются соединения, в узлах кристаллической решетки которых находятся сложные частицы (комплексные ионы), построенные за счет координации одним атомом (ионом) электронейтральных молекул или противоположно заряженных других ионов, способные к самостоятельному существованию при переходе соединения в расплавленное или растворенное состояние.
Лиганды отличаются по силе своего воздействия на комплексообразователи. Объясняется это энергетическим потенциалом лигандов. По величине энергии лиганды располагаются в следующем порядке (спектрохимический ряд лигандов):
СО > СN– > NH2-CH2-CH2-NH2 > NH3 > SCN– > H2O > OH– > F– >Cl– > Br– > I–
сильное: среднее поле: слабое поле
поле
В начале этого ряда находятся лиганды, создающие наиболее сильное поле, в конце – слабое.
 Лиганды, создающие сильное поле, оказывают более значительное влияние на энергетическое состояние d-подуровня комплексообразователя. В результате меняется распределение электронов по орбиталям, что будет вести к иному типу гибридизации, а в итоге к иной структуре и к иным свойствам образующегося комплексного соединения. Так, если в комплексной соли K2[NiCl4] четыре вакантные орбитали иона Ni2+ под влиянием слабого поля Cl– находятся в состоянии sp3-гибридизации, с тетраэдрическим расположением лигандов в пространстве (рис. 1.2), то в комплексной соли никеля (II) c цианид-ионами (K2[Ni(CN)4]) тетраэдрическая конфигурация комплексного иона трансформируется в плоскостную квадратную (рис. 1.4.). Вызвано это тем, что во втором комплексе, под влиянием сильного электрического поля цианид-ионов, сначала имеет место обобщение двух
Лиганды, создающие сильное поле, оказывают более значительное влияние на энергетическое состояние d-подуровня комплексообразователя. В результате меняется распределение электронов по орбиталям, что будет вести к иному типу гибридизации, а в итоге к иной структуре и к иным свойствам образующегося комплексного соединения. Так, если в комплексной соли K2[NiCl4] четыре вакантные орбитали иона Ni2+ под влиянием слабого поля Cl– находятся в состоянии sp3-гибридизации, с тетраэдрическим расположением лигандов в пространстве (рис. 1.2), то в комплексной соли никеля (II) c цианид-ионами (K2[Ni(CN)4]) тетраэдрическая конфигурация комплексного иона трансформируется в плоскостную квадратную (рис. 1.4.). Вызвано это тем, что во втором комплексе, под влиянием сильного электрического поля цианид-ионов, сначала имеет место обобщение двух
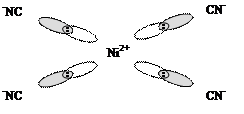
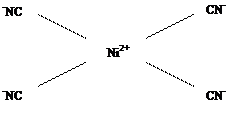
Или
Рис. 1.4. Комплексный ион [Ni(CN)4]2–
 неспаренных d-электронов Ni2+, которые занимают 3dz2-орбиталь (см. ниже схему), а освободившаяся 3d x2–y2 - орбиталь, а также 4s- и две 4р-орбитали участвуют далее в гибридизации с образованием четырех эквивалентных dsp2-орбиталей, направленных в плоскость квадрата:
неспаренных d-электронов Ni2+, которые занимают 3dz2-орбиталь (см. ниже схему), а освободившаяся 3d x2–y2 - орбиталь, а также 4s- и две 4р-орбитали участвуют далее в гибридизации с образованием четырех эквивалентных dsp2-орбиталей, направленных в плоскость квадрата:
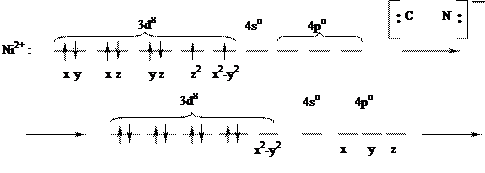
 |
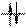
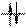
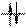
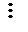
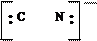
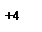
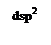


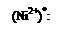

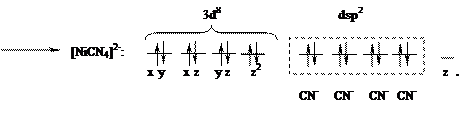
В комплексе с цианид-ионами у центрального иона не остается неспаренных электронов и он не обладает магнитными свойствами (диамагнитен, μ = 0). При комплексообразовании с ионами хлора, имеющими слабое поле, два электрона не спарены. Неспаренные электроны, вращаясь вокруг собственных осей, создают магнитный момент. Магнитный момент молекул (μ) складывается из магнитных моментов неспаренных электронов. Если молекула содержит неспаренные электроны, то μ≠0 и вещество парамагнитно, т.е. втягивается в магнитное поле. Когда неспаренных электронов нет и μ = 0, вещество диамагнитно и слабо выталкивается из магнитного поля. Наличие двух неспаренных электронов у атома Ni2+ в комплексе K2[NiCl4] обуславливает его парамагнетизм.
Достоинство метода валентных связей в том, что уже многие десятилетия он дает химикам простую, наглядную модель связывания атомов, успешно объясняет определенные значения координационных чисел и геометрические формы комплексных частиц. Правильно описываются с позиций метода и различия в магнитных свойствах – диамагнитизм и парамагнетизм. Однако основанный на ряде допущений, он не в состоянии объяснить спектры поглощения и строение некоторых, особенно открытых в последнее время, комплексов, например, «сэндвичевых». Кроме того, взаимодействие центрального атома (иона) с лигандами не всегда сводится к элементарному акту передачи электронов лигандом. Известны лиганды, сами способные принимать электроны металла на свои вакантные орбитали, например, на свободные d-орбитали в молекуле PF3 или в ионе SnCl3–. Сомнительно также, чтобы на центральном ионе могла осуществляться концентрация столь высокого отрицательного заряда, который бы создавался, если бы каждый лиганд стал отдавать ему свою пару электронов.
 2015-07-14
2015-07-14 3107
3107








