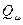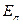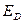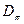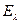Дескрипторы молекулярной структуры представляют собой численные характеристики, отражающие структурные особенности молекулы. В общем случае, все дескрипторы принято условно делить на две группы: индексы электронной структуры и энергетические индексы. Первые позволяют судить о распределении электронной плотности в молекуле, характере 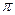 - электронного связывания, полярности молекулы, количестве и пространственном расположении электрофильных и нуклеофильных центров, неспаренных электронов в радикалах. Последние, в свою очередь, позволяют составить представление относительно энергии химической связи, устойчивости
- электронного связывания, полярности молекулы, количестве и пространственном расположении электрофильных и нуклеофильных центров, неспаренных электронов в радикалах. Последние, в свою очередь, позволяют составить представление относительно энергии химической связи, устойчивости 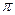 - электронной системы и конформации в целом, характере электронных спектров, величинах энергий ионизации и сродства к электрону. Расчёт этих параметров позволяет не только обдуманно подходить к вопросам прогнозирования свойств и реакционной способности молекул, но и позволяет перейти непосредственно к моделированию новых соединений с заранее заданными свойствами. В настоящее время современная технология ставит своей задачей разработку методов надёжного предсказания физико – химических свойств (в том числе и биологической активности) различных классов химических соединений. Для реализации задачи «структура - свойства», являющейся на сегодняшний день многопрофильной задачей, имеются различные подходы – топологический, факторный, регрессионный, статистический и др. Хорошие перспективы при решении данной задачи имеют методы квантовой химии, с помощью которых можно проводить расчёты электронной структуры и геометрии самых разнообразных химических систем, вплоть до моделирования эффектов среды. Для того чтобы найти соотношение между заданным набором физико – химических свойств органических соединений и их структурой, последние представляют в численном виде. Численные характеристики, отражающие структурные особенности молекулы, получили название дескрипторов молекулярной структуры. Последние могут быть вычислены с использованием методов квантовой химии. В рамках данной работы, нами будет рассмотрено применение простейшего подхода – полуэмпирического метода молекулярных орбиталей Хюккеля (МОХ). Применение метода молекулярных орбиталей неизбежно приводит к необходимости пересмотра многих классических представлений о химической связи, в том числе и органической химии. Строение молекулы может быть описано с разной степенью детализации. Так, брутто – формула показывает, сколько и какие атомы содержатся в молекуле. Структурная формула учитывает лишь типы атомов и характер их связывания, игнорируя при этом геометрические характеристики, являясь малоинформативной. В рамках же метода ЛКАО – МО, можно получить дополнительную информацию относительно электронной плотности в молекуле – значения электронных плотностей на атомах, порядков связей, индексы свободных валентностей. Их значения принято изображать на молекулярном графе. Такое наглядное представление результатов расчёта называют молекулярной диаграммой. По сравнению с обычной структурной формулой, молекулярная диаграмма передаёт значительно больше информации о свойствах молекулы, её реакционной способности, характере
- электронной системы и конформации в целом, характере электронных спектров, величинах энергий ионизации и сродства к электрону. Расчёт этих параметров позволяет не только обдуманно подходить к вопросам прогнозирования свойств и реакционной способности молекул, но и позволяет перейти непосредственно к моделированию новых соединений с заранее заданными свойствами. В настоящее время современная технология ставит своей задачей разработку методов надёжного предсказания физико – химических свойств (в том числе и биологической активности) различных классов химических соединений. Для реализации задачи «структура - свойства», являющейся на сегодняшний день многопрофильной задачей, имеются различные подходы – топологический, факторный, регрессионный, статистический и др. Хорошие перспективы при решении данной задачи имеют методы квантовой химии, с помощью которых можно проводить расчёты электронной структуры и геометрии самых разнообразных химических систем, вплоть до моделирования эффектов среды. Для того чтобы найти соотношение между заданным набором физико – химических свойств органических соединений и их структурой, последние представляют в численном виде. Численные характеристики, отражающие структурные особенности молекулы, получили название дескрипторов молекулярной структуры. Последние могут быть вычислены с использованием методов квантовой химии. В рамках данной работы, нами будет рассмотрено применение простейшего подхода – полуэмпирического метода молекулярных орбиталей Хюккеля (МОХ). Применение метода молекулярных орбиталей неизбежно приводит к необходимости пересмотра многих классических представлений о химической связи, в том числе и органической химии. Строение молекулы может быть описано с разной степенью детализации. Так, брутто – формула показывает, сколько и какие атомы содержатся в молекуле. Структурная формула учитывает лишь типы атомов и характер их связывания, игнорируя при этом геометрические характеристики, являясь малоинформативной. В рамках же метода ЛКАО – МО, можно получить дополнительную информацию относительно электронной плотности в молекуле – значения электронных плотностей на атомах, порядков связей, индексы свободных валентностей. Их значения принято изображать на молекулярном графе. Такое наглядное представление результатов расчёта называют молекулярной диаграммой. По сравнению с обычной структурной формулой, молекулярная диаграмма передаёт значительно больше информации о свойствах молекулы, её реакционной способности, характере 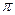 - электронного связывания. На основе решений МОХ, в рамках
- электронного связывания. На основе решений МОХ, в рамках 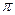 - электронного приближения, была разработана система дескрипторов молекулярной структуры, которые представляют собой численные характеристики, отражающие структурные особенности молекулы. Все дескрипторы принято условно делить на две группы: индексы электронной структуры и энергетические индексы.
- электронного приближения, была разработана система дескрипторов молекулярной структуры, которые представляют собой численные характеристики, отражающие структурные особенности молекулы. Все дескрипторы принято условно делить на две группы: индексы электронной структуры и энергетические индексы.
Таблица 7. Дескрипторы молекулярной структуры.
|
Так, если первые позволяют судить о распределении электронной плотности в молекуле, характере 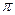 - электронного связывания, полярности молекулы, количестве и пространственном расположении электрофильных и нуклеофильных центров, неспаренных электронов в радикалах, то последние позволяют составить представления относительно энергии, прочности химической связи, устойчивости
- электронного связывания, полярности молекулы, количестве и пространственном расположении электрофильных и нуклеофильных центров, неспаренных электронов в радикалах, то последние позволяют составить представления относительно энергии, прочности химической связи, устойчивости 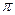 - электронной системы и конформации в целом, характере электронных спектров, величинах энергии ионизации и сродства к электрону, позволяющих в свою очередь судить о кислотно – основных и окислительно – восстановительных свойствах рассматриваемой молекулы. Расчёт этих параметров позволяет, таким образом, не только обдуманно подходить к вопросам прогнозирования свойств и реакционной способности молекул, но и позволяет перейти непосредственно к моделированию новых соединений с заранее заданными свойствами.
- электронной системы и конформации в целом, характере электронных спектров, величинах энергии ионизации и сродства к электрону, позволяющих в свою очередь судить о кислотно – основных и окислительно – восстановительных свойствах рассматриваемой молекулы. Расчёт этих параметров позволяет, таким образом, не только обдуманно подходить к вопросам прогнозирования свойств и реакционной способности молекул, но и позволяет перейти непосредственно к моделированию новых соединений с заранее заданными свойствами.
 2015-03-22
2015-03-22 2150
2150