Определить адиабатическую температуру горения органической массы, состоящей из: С-60%, Н-7%, О-25%, W-8%.
Решение:
1. Так как горючее представляет собой сложное вещество, состав продуктов горения рассчитываем по формулам(1.16 и 1.19):
Vco2=1.86∙60/100+1,12 м3/кг;
VН2О=11,2 ∙7/100+1,24∙8/100=0,88 м3/кг;
VN2=1/100∙7∙60+21(7-25/8)=5,01 м3/кг
2. Общий объем продуктов горения равен: VПr=7,01 м3/кг.
3. Определим низшую теплоту сгорания вещества по формуле Д.И.Менделеева (2.3):
Qн=339,4∙60+1157∙7-108,9∙25-25,1(9∙7+8)=23958,4 кДж/кг;
4. Определим среднюю энтальпию продуктов горения:
∆Н ср =23958,4/7,01=3417,7кДж/м3
5. Так как величина энтальпии рассчитана в кДж/м3. первую приближенную температуру выбираем по табл.2 приложения. Ориентируясь на азот, принимаем Т1=21000С
6. Рассчитаем теплосодержание продуктов горения при 21000С по формуле (2.13):
Q пр=5118,2∙1,12+4166,1∙0,88+3142,9∙5,01=25144,5 кДж/кг
7. Из сравнения Qн и Qпr,так как Qн 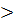 Qпр выбираем вторую приближенную температуру 19000С. Рассчитываем теплосодержание продуктов горения при 19000С:
Qпр выбираем вторую приближенную температуру 19000С. Рассчитываем теплосодержание продуктов горения при 19000С:
Q 2пr=5118,2∙1,12+3693,5∙0,88+2818,2∙5,01=22498,8 кДж/кг
8. Так как Q2 пr 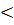 Qн<Q1 пr определим температуру горения:
Qн<Q1 пr определим температуру горения:
Тr *=1900+ 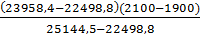 =20100С
=20100С
 2015-03-22
2015-03-22 1447
1447








