В задание входит (по указанию преподавателя) исследование катодной защиты углеродистой стали от коррозии в водных растворах NaCl или анодной защиты хромоникелевой стали Х18Н10 в 20 %-ном водном растворе серной кислоты. Работы проводят на разных установках, которые собраны по одной схеме (рис. 26).
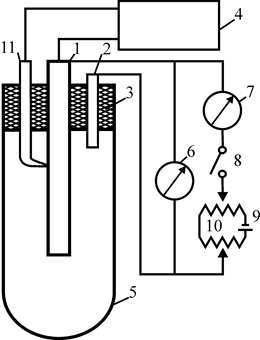
Рис. 26. Схема установки для исследования защиты сталей внешним током от коррозии:1 – испытуемый стальной образец; 2 – дополнительный графитовый (платиновый) электрод; 3 – пробка-держатель; 4 – катодный вольтметр; 5 – стеклянный трубчатый сосуд; 6 –милливольтметр; 7 – микроамперметр; 8 – двухполюсный рубильник; 9 – источник постоянного тока (выпрямитель, аккумулятор); 10 – движковые реостаты; 11 – электрод сравнения
Радиус действия электрохимической защиты внешним током (анодной или катодной) определяется расстоянием от верхнего края испытуемого образца до ближайшего очага коррозии. Для этого в исследуемый раствор вводят 2-3 мл 10 %-ного раствора гексационоферрата калия K5[Fe(CN)6]. Появление в растворе у поверхности образца двухвалентных ионов железа (протекание коррозионного процесса) фиксируется появлением на его поверхности синих пятен вследствие образования имеющего синий цвет комплексного соединения железа Fe3[Fe(CN)6] по реакции:
3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]. (111)
Исследование катодной защиты. Образец 1 зачищают наждачной бумагой, тщательно обезжиривают и закрепляют в пробке-держателе 3, следя за тем, чтобы оттянутый конец изогнутой стеклянной трубки, в которой располагается электрод сравнения 11, был плотно прижат к поверхности образца. Определяют рабочие поверхности образца и дополнительного электрода. Собирают электрическую часть схемы, как показано на рис. 26. Залив в стеклянный сосуд 5 исследуемый раствор, закрепляют в нем пробку-держатель 3 так, чтобы уровень раствора доходил до ее нижнего края. Замкнув рубильник 8, с помощью реостатов 10 устанавливают силу тока в цепи 100 мкА и измеряют катодным вольтметром 4 разность потенциалов между защищаемым образцом и дополнительным электродом. При появлении через 10-15 мин на поверхности образца синих пятен измеряют расстояние от верхнего края образца до ближайшего пятна, определяя таким образом радиус действия защиты. Образец извлекают из раствора, промывают струей холодной воды и протирают фильтровальной бумагой. В соответствии с заданием преподавателя опыт повторяют:
1 – в том же растворе, устанавливая силу тока в цепи 200, 300, 400, 500 мкА, добиваясь того, чтобы радиус защиты был равен всей длине образца;
2 – в растворах с различной концентрацией (0; 0,1; 0,5; 1,0; 1,5) NaCl;
3 – в растворе 0,5 % NaCl с другими значениями рН (рН = 7; рН = 2-3; рH=9-10).
При исследовании анодной защиты (см. рис. 26) закрепленный в пробке-держателе образец также устанавливают в трубчатом сосуде с раствором (20 % H2SO4). Активируют образец, катодно поляризуя его в течение нескольких минут до появления значительного выделения на образце пузырьков водорода. Изменив рубильником 8 направление тока в цепи, с помощью реостатов 10 устанавливают силу тока в цепи 100 мкА. При появлении через 10-15 мин на поверхности образца синих пятен измеряют расстояние от верхнего края образца до ближайшего синего пятна, определяя таким образом радиус действия защиты. В последующих опытах увеличивают силу тока в цепи (200, 300, 400, 500 мкА), добиваясь того, чтобы радиус действия защиты был равен всей длине образца.
 2015-03-22
2015-03-22 857
857








