| Последовательность действий | Сколько граммов уксусной кислоты образовалось при окислении 220г уксусного альдегида? |
| 1. Пишем уравнение реакции | 2СН3СНО + О2 2СН3СООН |
| 2. Пишем над формулами заданные и искомые значения. | 220г Х 2СН3СНО + О2 2СН3СООН |
| Под формулами этих же соединений массы, рассчитанные исходя из их молярных масс и числа молей (по формуле т = п * М) | 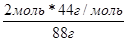 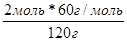 |
| 3. Составляем пропорцию | 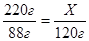 |
| 4. Решаем пропорцию | 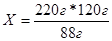 |
| Х = 300г |
Расчет объемов при химических реакциях
| Последовательность действия | Сколько литров метилхлорида выделиться при взаимодействии хлора с 40г метана. |
 1. Пишем уравнение реакции 1. Пишем уравнение реакции | СН4 + Cl2 CH3Cl + HCl |
   2. Пишем над формулами заданные и искомые величины, под формулами этих же соединений их массовые и объемные количества, рассчитанные исходя из их молярных масс, молярных объемов и числа молей. 2. Пишем над формулами заданные и искомые величины, под формулами этих же соединений их массовые и объемные количества, рассчитанные исходя из их молярных масс, молярных объемов и числа молей. | 40г л СН4 + Cl2 CH3Cl + HCl 16г 22,4л 16 г/моль * 1 моль 22,4г/моль * 1 моль |
| 3. Составляем пропорцию | 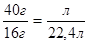 |
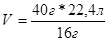 | |
| V = 56л |
| Последовательность действия | Определить объемный расход хлора в реакции получения 1920кг метилхлорида |
 1. Пишем уравнение реакции 1. Пишем уравнение реакции | СН4 + Cl2 CH3Cl + HCl |
 2. Пишем над формулами заданные и искомые значения. 2. Пишем над формулами заданные и искомые значения. | 1920кг СН4 + Cl2 CH3Cl + HCl 22,4м3 50,5кг |
| Под формулами этих же соединений их весовые и объемные количества (по формуле т = п * М, V = n *Vм) | т = п * М, V = n *Vм V = 1 кмоль * 22,4 м3/кмоль V = 22,4 м3 т =1 кмоль * 50,5кг/кмоль т =50,5кг |
| 3. Составляем пропорцию | 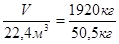 |
| 4. Решаем пропорцию | 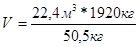 |
| V = 851,6 м3 |
Вычисление массы продукта реакции по известному количеству исходых веществ с учетом его практического выхода.
Пример1. Сколько этилового спирта образуется при гидролизе 600кг этилена, если выход составляет 90%.
Решение 1: Напишем уравнение реакции и определим выход этилового спирта (теоретический).
600кг Х
 СН2 = СН2 + НОН СН3СН2ОН
СН2 = СН2 + НОН СН3СН2ОН
228кг 46кг
т = п * М
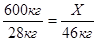

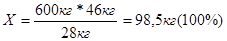
2. Определяем массу практического выхода продукта.
98,5кг – 100% 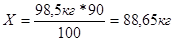
Х – 90%
Вычисление массы продукта реакции по известному объему исходных веществ с учетом процента выхода продукта
Пример2. Напишите уравнения реакций получения акрилонитрила из ацетилена. Рассчитайте, сколько можно получить полимера из 448м3 ацетилена (н.у.), если выход полимера составляет 90% от теоретического7
Решение: 1. Напишем уравнение реакции получения акрилонитрила, запишем над формулами заданные и искомые значения, под формулами количества и объем, рассчитанные исходя из их молярных масс, молярных объемов и числа молей.
448м3 Х кг
 СН = СН + НСN СН2 = СН – СN
СН = СН + НСN СН2 = СН – СN
22,4м3 53кг
т = п * М, 1кмоль * 53кг/кмоль
V = n *Vм 1кмоль * 22,4м3/кмоль
2. Определяем, сколько килограммов образуется акрилонитрила из 448м3 теоретически.
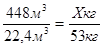
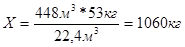
3. Напишем уравнение реакции полимеризации акрилонитрила.




 1060кг Хкг
1060кг Хкг


 СН2 = СН - СН2 - СН –
СН2 = СН - СН2 - СН –
 СN СN
СN СN

 53кг 53кг
53кг 53кг
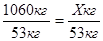 ;
; 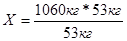 ; Х = 1060кг
; Х = 1060кг
Так как по условию выход полимера 90%.
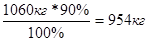
Вычисление массы продукта реакции когда одно из реагирующих веществ взято в избытке.
Задачи такого типа решаются исходя их уравнения химической реакции. Для вычисления массы продукта реакции используется исходное вещество взятое в недостатке. Поэтому первоначально необходимо установить, какое из исходных веществ взято в недостатке и какое в избытке.
Пример3. Сколько граммов бромэтила образуется при взаимодействии 92г этилового спирта с 40,5г бромводорода.
40,5г Х
 С2Н5ОН + НBr С2Н5 Br + Н2О
С2Н5ОН + НBr С2Н5 Br + Н2О
 |  |  |
46г 81г 109г
т С2Н5ОН = 1 моль * 46г/моль
т С2Н5 Br = 1 моль * 109 г/моль
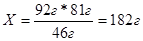
Следовательно, на 92г этилового спирта требуется 182г бромводорода, а по условию задачи дано 40,5г. значит, бромводород взят в недостатке, по нему следует вычислять массу продукта реакции.
40,5г Х
 С2Н5ОН + НBr С2Н5 Br + Н2О
С2Н5ОН + НBr С2Н5 Br + Н2О
 |  |
81г 109г
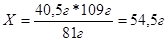
 2015-03-07
2015-03-07 1221
1221
