Жидкое состояние, занимая промежуточное положение между газами и кристаллами, сочетает в себе некоторые черты обоих состояний. В расположении частиц жидкости наблюдается так называемый ближний порядок. Это означает, что по отношению к любой частице расположение ближайших к ней соседей является упорядоченным. Однако по мере удаления от данной частице расположение по отношению к ней других частиц становится все менее упорядоченным, и довольно быстро порядок в расположении частиц полностью исчезает. Промежуточным положением жидкостей обусловлено и то обстоятельство, что жидкое состояние оказывается особенно сложным по своим свойствам. До сих пор нет вполне законченной и общепризнанной теории жидкостей.
Молекулы являются нейтральными частицами, поэтому жидкости не должны проводить электрический ток. Но известно, что даже самая чистая, дегазированная вода вследствие очень слабой ее диссоциации на ионы Н+ и ОН- имеет электрическую проводимость. Хорошо проводят электрический ток растворы электролитов.
Растворами называются, состоящие из двух или нескольких веществ, гомогенные системы, состав которых может изменяться в довольно широких пределах. Процесс растворения нельзя рассматривать как простое механическое распределение одного вещества в другом. При растворении имеет место физико-химическое взаимодействие растворяемого вещества с молекулами растворителя. Механизм растворения твердых тел в жидкости состоит в основном из трех стадий.
Рассмотрим растворение кристалла хлорида натрия, который состоит из электростатически связанных ионов натрия и хлора. При погружении кристалла в воду полярные молекулы Н2О ориентированы таким образом, что к иону Nа+ они обращены своими отрицательными полюсами, а к иону Cl- - положительными. Происходит явление гидротации. В результате межионная связь Nа+ - Cl- разрывается и образуются ионы Nа+, Cl-. На второй стадии растворения происходит гидротация этих ионов. Третья стадия растворения – это самопроизвольный процесс диффузии гидротированных ионов по всему объему растворителя.
Растворы, проводящие электрический ток, называются электролитами. В растворах электролитов перенос электричества осуществляется за счет перемещения ионов. В электролитах не все молекулы растворяемого вещества диссоциируют на ионы. В состоянии равновесия доля молекул, распавшихся на ионы характеризуется степенью электролитической диссоциации и обозначается через a. Степень электролитической диссоциации равна отношению числа молекул n, распавшихся на ионы, к общему числу растворенных молекул N:
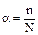
По способности к диссоциации электролиты делятся на три группы:
1) сильные электролиты - a>30%;
2) средние электролиты - a= 5¸30%;
3) слабые электролиты - a< 5%.
Примерами сильных электролитов в водных растворах могут служить некоторые неорганические основания (NaOH) и кислоты (HCl,HNO3), а также большинство неорганических и органических солей. К слабым электролитам в водных растворах относятся почти все органические кислоты и основания (CH3COOH, пиридин) и некоторые неорганические соединения.
Электрическая проводимость растворов электролитов, т.е. способность их проводить электрический ток, зависит от природы электролита и растворителя, концентрации, температуры и других факторов. Различают удельную и молярную электрическую проводимости.
Удельная электрическая проводимость электролита является величиной, обратной его удельному сопротивлению r:
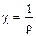 ,
,
а удельное сопротивление определяется из уравнения:
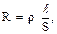
где R – электрическое сопротивление участка электролита, ℓ- длина этого участка, а S – площадь его поперечного сечения (рис.1). S = hd, где d – диаметр электрода, h – длина электрода.
| d h ℓ Рис.1 |
У тщательно очищенной воды, хранящейся в кварцевой или серебрянной посуде без доступа CO2, при 180C удельная электрическая проводимость равна c = 4, 4×10-8 Ом-1 см-1. В обычной дистиллированной лабораторной воде в результате растворения в ней двуокиси углерода и выщелачивания стекла c = 1× 10-6 Ом-1 см-1.
Молярная электрическая проводимость L равна электрической проводимости объема раствора электролита, содержащего 1г/моль растворенного вещества и находящегося между двумя параллельными электродами, расположенными на расстоянии одного метра друг от друга.
Удельная и молярная проводимости связаны между собой следующим соотношением:
L = 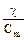 ,
,
где Сm – концентрация раствора, выраженная в моль/м3.
Молярная электрическая проводимость зависит от двух факторов: от степени диссоциации электролита и от электрического взаимодействия между ионами. С увеличением концентрации электролита в растворе уменьшается степень диссоциации и увеличивается электростатическое взаимодействие между ионами. Это приводит к уменьшению молярной электрической проводимости. Для растворов слабых электролитов молярная электрическая проводимость изменяется с концентрацией электролита из-за изменения степени диссоциации 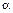 и с увеличением концентрации резко падает.
и с увеличением концентрации резко падает.
В растворах сильных электролитов изменение молярной электрической проводимости с концентрацией обусловлено влиянием электрического взаимодействия ионов на скорость их движение (коэффициент электрической проводимости). Молярная электрическая проводимость сильных электролитов сравнительно медленно уменьшается с концентрацией.
В разбавленных растворах удельная электрическая проводимость сильных электролитов увеличивается почти пропорционально концентрации.
Упражнение 1. Определение электропроводности дистиллированной воды
 2015-03-07
2015-03-07 519
519








