9.1. Общие положения
Системы, в которых одна составная часть распределена в мелкораздробленном состоянии в среде другой, называются дисперсными.
Составная часть, распределённая в виде отдельных мелких твёрдых частиц, капелек жидкости или пузырьков газа, составляет дисперсную фазу,
а другая часть, окружающая частицы дисперсной фазы, называется дисперсионной средой.
Дымы и туманы в воздухе, взвеси глины и песка в воде, коллоидные системы, содержащие частицы, более крупные, чем обычные молекулы, и, наконец, истинные растворы - молекулярные или ионные – всё это различные дисперсные системы.
В зависимости от размера частиц дисперсной фазы системы делятся на
а) грубодисперсные (взвеси) - диаметр частиц больше 10 –5 см;
б) коллоидно-дисперсные (золи) – 10–5 – 10 –7 см;
в) истинные растворы – размер частиц меньше 10–7 см.
Взвеси могут существовать в виде суспензий или эмульсий. В первом случае твёрдое вещество взвешено в жидкости (мел в воде), во втором – жидкое вещество в жидкости (жир в воде).
Частицы грубодисперсных систем различимы визуально и, если они распределены в жидкости или газе, то постепенно оседают или всплывают.
В коллоидных системах дисперсная фаза нерастворима в дисперсионной среде и отделена от неё поверхностью раздела; таким образом, коллоидные системы являются гетерогенными системами в отличие от истинных растворов, которые являются гомогенными, однородными. Если дисперсионная среда – жидкость, а дисперсная фаза – твёрдое вещество, коллоидная система называется золем; если дисперсная фаза – жидкость, система называется эмульсией.
Высокоразвитая поверхность раздела между дисперсной фазой и дисперсионной средой в коллоидных системах создаёт большой избыток поверхностной энергии. Поэтому с увеличением дисперсности (или удельной поверхности) коллоидные системы становятся менее устойчивыми. Они всегда стремятся к самопроизвольному уменьшению межфазной поверхности, т.е. к снижению дисперсности: частицы укрупняются, образуя более крупные агрегаты.
Свойство коллоидных систем увеличивать размер частиц путём их агрегации называется агрегативной неустойчивостью.
Для получения устойчивой коллоидной системы необходимо присутствие в системе стабилизатора. В большинстве случаев стабилизатором является электролит, находящийся в растворе. Один из ионов электролита адсорбируется на поверхности коллоидных частиц, сообщая им одноимённый заряд, препятствующий их агрегатированию (слипанию). Ионы противоположного знака находятся в дисперсионной среде.
9.2. Получение коллоидных систем
Благодаря тому, что коллоидные системы занимают промежуточное положение между грубодисперсными и молекулярно-дисперсными системами, их можно получить принципиально различными методами.
а) дисперсионные методы: дробление более крупных по размеру частиц до коллоидной степени дисперсности механическим измельчением частиц, электрическим диспергированием и ультразвуковым методом;
б) конденсационные методы: укрупнение частиц путём соединения (конденсации) атомов и молекул в агрегаты с коллоидно-дисперсной степенью дисперсности; к этой группе методов относят получение золей конденсацией паров, заменой растворителя и с помощью различных химических реакций (метод химической конденсации).
Основные условия, необходимые для получения и длительного хранения коллоидных систем, независимо от способов их получения, следующие:
1) нерастворимость частиц дисперсной фазы в дисперсионной среде;
2) достижение коллоидной степени дисперсности (10--5 – 10 --7 см) частицами дисперсной фазы;
3) наличие в системе третьего компонента - стабилизатора, который сообщает системе агрегативную устойчивость.
9.3. Строение мицелл золей
В настоящее время общепринятой теорией строения коллоидных частиц является мицеллярная теория, согласно которой мицелла - это агрегат молекул и ионов, состоящий из ядра и двойного электрического слоя. А двойной электрический слой состоит из адсорбционного слоя родственных ионов и противоионов и диффузного слоя противоионов. Мицелла электронейтральна, т.к. в ней число положительных ионов равно числу отрицательных. В электрическом поле коллоидные частицы перемещаются с постоянной скоростью к одному из электродов, т.к. обладают одноимённым зарядом (либо положительным, либо отрицательным). Наличие одноимённого заряда у всех частиц данного золя является важным фактором его устойчивости. Заряд препятствует слипанию, укрупнению и выпадению в осадок коллоидного вещества.
Чаще всего причиной возникновения заряда является процесс адсорбции ионов того или иного знака поверхностью частиц. По правилу Пескова-Фаянса: на любой твёрдой поверхности будут адсорбироваться те ионы, которые имеют с этой поверхностью общую родственную атомную группировку и находятся в растворе в избытке.
Пример 1. Примером получения золя методом двойного обмена может служить реакция 2H3AsO3 + 3H2S à As2S3 + 6H2O, в случае, если одно из веществ взято в избытке (оно будет выполнять роль стабилизатора), а другое – в недостатке (что предотвращает рост зародышей коллоидных частиц до крупных размеров). При избытке, например, H2S, идёт реакция
2H3AsO3 + 3H2S à As2S3 + 6H2O
изб ядро
В данных условиях молекулы As2S3, конденсируясь, образуют ядро мицеллы m[As2S3].
Известно, что вещество, которое берётся в избытке, является стабилизатором. В данном случаe им будет H2S, которая диссоциирует по уравнению:
H2S <=> H+ + HS–
По правилу Пескова-Фаянса на ядре m[As2S3] будут адсорбироваться ионы nHS– (как родственные и находящиеся в растворе в избытке). Эти ионы плотно прилегают к ядру и называются потенциалопределяющими. Они определяют направление движения коллоидной частицы при электролизе.
Далее отрицательно заряженные ионы HS– притягивают из раствора часть находящихся в избытке ионов Н+, образующих адсорбционный слой противоионов (n-x)H+.
Ядро m[As2S3], адсорбционный слой ионов nHS– и противоионов
(n-х)Н+ образуют гранулу, несущую отрицательный заряд, т.к. ионов nHS- больше, чем (n-х)H+ на число х.
Другая часть противоионов хН+ образуют диффузную часть двойного электрического слоя, окружающего ядро мицеллы.
Схема строения мицеллы золя сульфида мышьяка:
{[mAs2S3] * nHS– * (n-x)H+ }x – * xH+
| < ядро >| <адсорбционный >| < диффузный |
| | слой | слой |
|< ---------- гранула -----------> | |
| < -------------- мицелла ----------------------- > |
В электрическом поле гранула, имеющая отрицательный заряд, перемещается к аноду, а противоионы – к катоду.
9.4. Явление коагуляции
Коагуляция - процесс слипания частиц с образованием более крупных агрегатов. Внешне коагуляция проявляется в помутнении золя, в изменении окраски золя, в выпадении твёрдой фазы в осадок или в образовании студнеобразной массы.
Коагуляция происходит вследствие уменьшения электрокинетического
(или 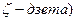 потенциала или вследствие потери сольватной оболочки.
потенциала или вследствие потери сольватной оболочки.
Коагуляцию коллоидных растворов можно вызвать нагреванием, замораживанием, интенсивным перемешиванием, прибавлением к золю электролита.
Наиболее изучена коагуляция при добавлении к золю электролитов. Коагуляция электролитами подчиняется правилам Шульце-Гарди, которые можно сформулировать следующим образом:
1) коагуляцию вызывает ион, заряженный противоположно грануле золя;
2) чем больше заряд коагулирующего иона, тем сильнее его коагулирующее действие.
Минимальное количество электролита, прибавляемое к золю, которое может вызвать коагуляцию золя, называют порогом коагуляции С(пор) моль/л.
Примеры решения задач
Пример 2. Определение заряда коллоидных частиц.
Золь иодида серебра AgJ получен при добавлении к 0,02 л 0,01н. раствора KJ 0,028 л 0,005 н. AgNO3. Определите заряд полученного золя и напишите формулу его мицеллы.
Решение:
При смешивании растворов AgNO3 и KJ протекает реакция:
AgNO3 + KJ = AgJ + KNO3
Определяем количества AgNO3 и KJ, участвующих в реакции:
а) n (AgNO3 )= 0,005 . 0,028 = 1,4 . 10-4 (моль);
б) n (KJ) = 0,02 . 0,01 = 2,0 . 10-4 (моль).
Расчёт показывает, что в растворе избыток KJ, следовательно, ядром коллоидных частиц золя иодида серебра будут адсорбироваться ионы J – и частицы золя приобретают отрицательный заряд. Противоионами являются ионы К+. Формула мицеллы золя иодида серебра при условии избытка KJ имеет вид:
{m[AgJ] 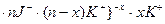 ;
;
Пример 3. Определение минимального объёма электролита, необходимого для получения золя.
Какой объём 0,002 н. раствора BaCl2 надо прибавить к 0,03 л 0,0006 н.Al2(SO4)3, чтобы получить положительно заряженные частицы золя сульфата бария. Напишите формулу мицеллы золя BaSO4.
Решение:
Образование золя BaSO4 происходит по уравнению:
BaCl2 + Al2(SO4)3 = 3BaSO4 + 2AlCl3
Если вещества участвуют в стехиометрических соотношениях, то для реакции необходимо:
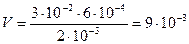 (л) раствора BaCl2
(л) раствора BaCl2
Для получения положительных частиц золя BaSO4 в растворе должен быть избыток хлорида бария по сравнению с сульфатом алюминия. Следовательно, для реакции нужно взять более 0,009 л 0,002 н. раствора BaCl2.
Формула мицеллы золя сульфата бария:
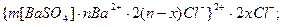
Пример 4. Вычисление порога коагуляции электролита с учётом его концентрации.
В каждую из трёх колб налито по 0,01 л золя хлорида серебра. Для коагуляции этого золя в первую колбу добавлено 0,002 л 1н. NaNO3, во вторую – 0,012 л. 0,01н. Сa(NO3)2; в третью – 0,007 л. 0,001н. Al(NO3)3. Вычислите пороги коагуляции электролитов, определите знак заряда частиц золя.
Решение:
Минимальное количество электролита, прибавляемого к золю, которое может вызвать коагуляцию золя, называется порогом коагуляции Спор (ммоль/л). Порог коагуляции может быть рассчитан по формуле:
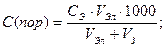
где СЭ - эквивалентная концентрация электролита (моль/л);
VЭл , VЗ - соответственно объёмы электролита и золя, л.
Вычисляем пороги коагуляции добавляемых электролитов:
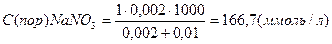
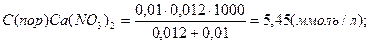
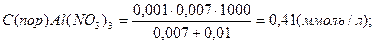
Добавляемые электролиты – NaNO3, Ca(NO3)3 и Al(NO3)3 cодержат анион NO3-- и катионы Na+, Ca2+ , Al3+ разной зарядности. Наименьший порог коагуляции у Al(NO3)3, следовательно, частицы золя хлорида серебра заряжены отрицательно.
Пример 5. Расчёт порога коагуляции.
Пусть молярная концентрация исходного электролита будет равна С, объём его, вызвавший коагуляцию, V; тогда число миллимолей электролита:
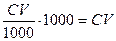 .
.
Порог коагуляции относится к одному литру золя, и если для его определения было взято w мл золя, то величина порога коагуляции будет:
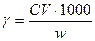 (ммоль/л)
(ммоль/л)
 2015-03-07
2015-03-07 8437
8437
