Коррозия – это разрушениеметалла в результате его физико-химического взаимодействия с окружающей средой. По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию.
Химическая коррозия представляет собой самопроизвольное разрушение металлов в среде окислительного газа (например, кислорода, галогенов) при повышенных температурах или в жидких неэлектролитах.
Уравнение реакции окисления металлов кислородом (пример газовой коррозии) можно записать в общем виде:
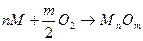 .
.
Электрохимическая коррозия протекает при контакте металла с растворами электролитов. Например, наиболее распространённая атмосферная коррозия протекает в тонких плёнках электролитов, которые возникают на поверхности металла в результате адсорбции, конденсации или прямого попадания воды и растворения в ней коррозионно-активных газов и солей (O2, SO2, CO2, NO2, NaCl и др.). Учитывая, что поверхность металла всегда энергетически неоднородна (из-за наличия примесей в металле, различий по химическому и фазовому составу сплава и др.), на участках металла, имеющих более отрицательное значение потенциала, пойдёт процесс окисления этого металла. Таким образом, при электрохимической коррозии разрушение металла происходит в результате работы огромного количества коррозионных микроэлементов. При этом на корродирующем металле протекает анодная реакция:
АНОД M → Mn+ + ne-,
а на участках металла с более положительным потенциалом – катодное восстановление окислителя (Ox):
КАТОД Ox + ne- → Red.
Наиболее распространёнными окислителями при электрохимической коррозии являются молекулы кислорода О2, воздуха и ионы водорода Н+ электролита.
Коррозия с участием кислорода называется коррозией с поглощением кислорода (с кислородной деполяризацией). В зависимости от рН среды возможны два механизма ионизации (восстановления) кислорода:
в щелочной или нейтральной среде
O2 + 2H2O + 4e- → 4OH- (pH≥7),
в кислой среде
O2 + 4H+ + 4e- → 2H2O (pH<7).
При коррозии с выделением водорода (с водородной деполяризацией) реакции выделения водорода имеют вид:
в щелочной или нейтральной среде
2H2O + 2e- → H2 + 2OH- (pH≥7),
в кислой среде
2H+ + 2e- → H2 (pH<7).
Если в качестве окислителя одновременно выступают О2 и Н+, то такая коррозия называется коррозией со смешанной деполяризацией.
Возможность протекания электрохимической коррозии может быть определена по знаку ЭДС элемента: если ЭДС элемента имеет положительное значение, то коррозия возможна. Так как ЭДС равна разности потенциалов окислителя и восстановителя Еэ=Еок-Евосст или разности потенциалов катода и анода Еэ=Ек-Еа, то коррозия возможна при условии, что потенциал окислителя (или катода) положительнее потенциала металла:
Еок > E(Mn+/M) или Ек > E(Mn+/M).
Равновесный потенциал кислородного электрода при 298 К описывается уравнением:
E (О2/ОН-) = 1.227 - 0.059●pH + 0.0147●lg p(О2),
а потенциал водородного электрода - уравнением:
E (H+/H2) = -0.0295●lg p(H2) - 0.059●pH.
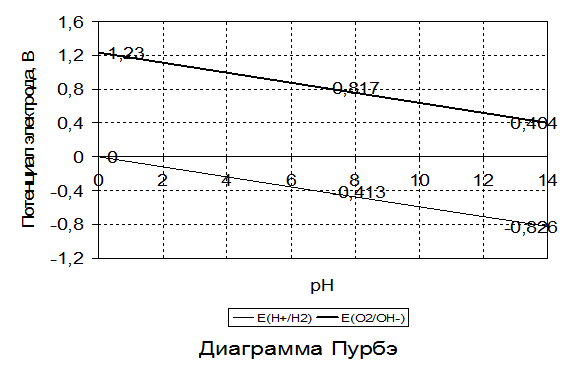
Для оценки возможности или невозможности протекания электрохимических процессов обычно используют диаграммы Пурбэ. Анализ диаграмм Пурбэ для разных металлов показывает, что в водных средах, содержащих О2 и Н+, металлы корродируют по-разному, в зависимости от рН:
а) если потенциал металла положительнее потенциала кислородного электрода (верхняя зона диаграммы), то коррозия металла невозможна (например потенциал золота);
б) если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода (средняя зона диаграммы), коррозия возможна с поглощением кислорода и невозможна с выделением водорода;
в) если потенциал металла отрицательнее потенциала водородного электрода (нижняя зона диаграммы), то возможна коррозия как с поглощением кислорода, так и с выделением водорода (щелочные и щелочно-земельные металлы, магний, алюминий, цинк и др.).
Примеры решения задач
Пример 1. Во сколько раз возрастает толщина плёнки при увеличении продолжительности равномерной газовой коррозии титана от 8 до 100 ч при 300 оС.
Решение:
На алюминии, хроме (при t<350 oC) и некоторых других металлах плёнка оксида растёт во времени τ по логарифмическому закону:
δ = k lnτ,
где δ – толщина плёнки.
Соответственно
δ1 = k ln8,
δ2 = k ln100.
Отсюда следует, что толщина плёнки (δ2/δ1) увеличится в 2.53 раза (ln(100/8)=2.53).
Пример 2. Определите скорость равномерной коррозии железа в (мм/год) и в [г/(м2●год)], если плотность коррозионного тока составляет 0.02 А/м2.
Решение:
Скорость равномерной коррозии, выраженная в г/(м2●с), равна
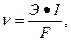
где Э – молярная масса эквивалента металла (г/моль);
I – плотность тока коррозии, А/м2;
F – число Фарадея, F = 96500 Кл/моль.
Умножая эту величину на число секунд в сутки (3600●24) и число дней в году (365), получим скорость коррозии в году ν = 170 г/(м2●год). Для перевода этой размерности в мм/год используем плотность железа ρ=7.87 г/см3. После преобразования единиц получим ν = 0.022 мм/год.
Пример 3. Возможна ли электрохимическая коррозия олова (Sn) в водном растворе при рН=6 при контакте с воздухом, если относительные парциальные давления газов равны p(H2) = 1, p(O2) = 0.21? Напишите уравнения реакций анодного и катодного процессов. При каких значениях рН возможна коррозия с выделением кислорода?
Решение:
Найдём стандартный электродный потенциал олова (E0(Sn2+/Sn0=-0.136 В). По уравнению Нернста определим равновесные потенциалы вероятных окислителей (H+ и O2) при 25 оС, p(H2) = 1, p(O2) = 0.21
E (H+/H2) = -0.059●pH = -0.059●6 = -0.354 В,
E (О2/ОН-) = 1.227 - 0.059●pH + 0.0147●lg0.21= 1.227 - 0.059●6 – 0.01 = 0.873 В.
Рассчитаем ЭДС предполагаемых коррозионных микроэлементов:
ε1 = Ек(Н2) – Еа = -0.354 В – (-0.136 В) = -0.218 В < 0 – коррозия с выделением водорода невозможна.
ε2 = Ек(О2) – Еа = 0.873 В – (-0.136 В) = 1.009 В > 0 – коррозия с поглощением кислорода возможна.
Таким образом, уравнения реакций анодного и катодного процессов выглядят следующим образом:
(анод) Sn – 2e- → Sn2+
(катод) 1/2 O2 + 2H+ + 2e- → H2O.
Для выяснения диапазона значений рН, при которых возможна коррозия с водородной деполяризацией, решим неравенство:
ε1 = Ек(Н2) – Еа > 0.
После подстановки значений электродных потенциалов получим
-0.059●pH – (-0.136 В) > 0,
Откуда следует, что при значениях рН < 0.136/0.059 = 2.26 идёт процесс с выделением водорода.
Пример 4. Определите, будет ли корродировать медь (Cu) в деаэрированном (без содержания кислорода) растворе CuSO4 в кислом растворе с рН=0 и выделением водорода при его относительном парциальном давлении p(H2) = 0.1.
Решение:
Стандартный потенциал меди составляет E0(Сu2+/Cu0)=+0.337 В, а потенциал водорода рассчитаем по уравнению Нернста:
E (H+/H2) = -0.0295●lg p(H2) - 0.059●pH = -0.0295●lg0.1 - 0.059●0 = +0.0295 В.
ЭДС коррозионного микроэлемента:
ε = Ек(Н2) – Еа = +0.0295 В – 0.337 В < 0 – коррозия протекать не будет.
Пример 5. Определите возможность электрохимической коррозии с водородной деполяризацией гальванической пары Сu-Zn, погруженной в 0.01М раствор ZnSO4 при 25 oC. Как изменится ЭДС коррозионного элемента в результате концентрационной поляризации анода, если концентрация раствора возросла до 0.05 моль/л?
Решение:
С учётом гидролиза соли, образованной слабым основанием и сильной кислотой, рассчитываем рН раствора:
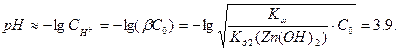
Равновесный потенциал водорода в предположении, что его относительное давление равно 1:
E (H+/H2) = -0.059●pH = -0.230 В.
Для выбора корродирующего металла воспользуемся их стандартными потенциалами (E0(Сu2+/Cu0=+0.337 В, E0(Zn2+/Zn0=-0.763 В). Потенциал меди значительно положительнее потенциала предполагаемого катода, и электрохимическая коррозия идёт с участием цинка. Запишем процессы в коррозионном элементе:
(анод) Zn – 2e- → Zn2+
(катод) 2H+ + 2e- → H2.
Для расчёта ЭДС указанного микроэлемента уточним равновесный потенциал цинка, используя уравнение Нернста для 25 oC:
E1(Zn2+/Zn0) = -0.763 + (0.059/2)●lg10-2.
При увеличении концентрации ZnSO4 его потенциал изменяется:
E2(Zn2+/Zn0) = -0.763 + (0.059/2)●lg(5●10-2) = E1(Zn2+/Zn0) + (0.059/2)●lg5.
Таким образом, учитывая, что ε = Ек – Еа, значение ЭДС уменьшится на величину
Δε = (0.059/2)●lg5 = 0.02 В.
Пример 6. Определите возможность электрохимической коррозии стального изделия (железа) в 0.1М растворе FeCl2, комнатной температуре (T=298 K) при следующих относительных парциальных давлениях водорода и кислорода: p(H2) = 0.1, p(O2) = 0.9.
Решение:
Указанная соль подвергается гидролизу. Учитывая первую ступень гидролиза:
Fe2+ + H2O ↔ H+ + FeOH+, можно определить значение рН, величина которого, как видно из реакции меньше 7, т.е. коррозия идёт в подкисленной среде.
Найдём рН раствора, принимая активность ионов равной их концентрации:
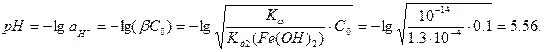
Теперь можно определить равновесные электродные потенциалы вероятных окислителей (H+ и O2):
E (H+/H2) = -0.0295●lg p(H2) - 0.059●pH = -0.0295●lg0.1 - 0.059●5.56 = -0.3 В,
E (О2/ОН-) = 1.227 - 0.059●pH + 0.0147●lg p(О2) = 0.9 В.
Равновесный потенциал предполагаемого анода при 25 oC:
E(Fe2+/Fe0) = E(Fe2+/Fe0) + (0.0592/2))●lg a(Fe2+) = -0.44 - (0.0592/2)●1 = -0.47 В.
Учитывая, что
ε1 = Ек(Н+) – Еа = -0.3 В – (-0.47 В) = +0.17 В > 0 – коррозия с выделением водорода возможна.
ε2 = Ек(О2) – Еа = 0.9 В – (-0.47 В) = +1.37 В > 0 – коррозия с поглощением кислорода также возможна.
Таким образом, возможна коррозия железа с протеканием на катоде двух реакций:
2H+ + 2e- → H2
1/2 O2 + 2H+ + 2e- → H2O.
Пример 7. Стальное изделие имеет цинковое покрытие. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадёт в нейтральную среду с рН=7? Подсчитайте ЭДС коррозионного элемента для стандартных условий. При каких рН прекратится процесс выделения водорода?
Решение:
Стандартный потенциал цинка составляет E0(Zn2+/Zn0)= -0.763 В, а потенциал железа E0(Fe2+/Fe0)= -0.44 В. Учитывая, что потенциал цинка более отрицателен, цинк является анодным покрытием. При этом железо не будет принимать участие в анодном процессе, т.е. не будет корродировать.
Равновесные потенциалы водорода и кислорода, при их парциальных давлениях, равных 1, определяем по уравнениям
E (H+/H2) = - 0.059●pH = - 0.059●7 = -0.413 В,
E (О2/ОН-) = 1.227 - 0.059●pH = +0.814 В.
ЭДС коррозионных микроэлементов равны:
ε1 = Ек(Н+) – Еа = -0.413 В – (-0.763 В) = +0.35 В > 0 – коррозия с выделением водорода возможна;
ε2 = Ек(О2) – Еа = 0.814 В – (-0.763 В) = +1.577 В > 0 – коррозия с поглощением кислорода также возможна.
Катодные процессы:
2H2O + 2e- → 2OH- + H2
1/2 O2 + H2O + 2e- → 2OH-.
Процесс выделения водорода прекратится, если ε1<0,т.е. - 0.059●рН – (-0.763) <0, откуда следует, что рН<12.9 ε1<0, при этом процесс коррозии цинка с поглощением кислорода будет иметь место при любых значениях рН.
 2015-03-07
2015-03-07 7286
7286
