Первопричиной коррозии является термодинамическая неустойчивость металлов в различных средах при данных внешних условиях. Принципиальная возможность самопроизвольного протекания процесса коррозии определяется законами термодинамики.
Стремление металла перейти из металлического в ионное состояние характеризуется величиной уменьшения свободной энергии, что и составляет сущность процесса химической коррозии.
В качестве критерия равновесия и самопроизвольности процессов коррозии металлов наиболее удобно пользоваться изобарно-изотермическим потенциалом.
Δ G – функцией состояния системы, убыль которой в обратимом процессе при постоянных давлениях и температуре равна максимальной полезной работе.
Таким образом, процесс можно охарактеризовать тремя состояниями системы:
• 1) коррозионный процесс невозможен Δ G > 0;
• 2) коррозионный процесс возможен Δ G < 0;
• 3) система находится в равновесии Δ G = 0.
Движущей силой процесса коррозии является изобарно-изотермический потенциал Δ G, который является свойством вещества, выражающим одновременно как энтальпию, т.е. энергию, так и энтропию – степень беспорядка. Эти величины связаны уравнениями:
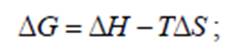
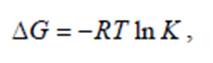
Однако, хотя термодинамика дает возможность определить, насколько изучаемая система отдалена от состояния равновесия и способна к самопроизвольной реакции, она не дает ответа, с какой скоростью будет протекать термодинамически возможный процесс. Скорость коррозионного процесса определяется кинетикой процесса.
Особенностью коррозионных процессов является их гетерогенный характер. Это связано с тем, что разрушение металла происходит на границе двух фаз, имеющих различное агрегатное состояние, например на границе металл – жидкость, металл – газ.
В условиях гетерогенности кинетика химического взаимодействия определяется двумя факторами:
- скорость протекания химического взаимодействия
- подвод реагентов из объемов соприкасающихся фаз на границу фаз, где происходит коррозионное взаимодействие, и отвод продуктов реакции в обратном направлении.
В первом случае скорость коррозии определяется кинетическим контролем, во втором – диффузионным. В некоторых случаях скорость коррозии определяется смешанным диффузионно – кинетическим контролем. Для установившегося процесса скорость химической реакции и скорость диффузии равны.
Отличительной особенностью коррозионных процессов является их сложность и многостадийность. Коррозионный процесс состоит из нескольких стадий, которые могут протекать либо последовательно, либо параллельно.
Обычно коррозионный процесс состоит из трех основных стадий
1) перенос реагирующих веществ к поверхности раздела фаз;
2) собственно гетерогенная реакция;
3) отвод продуктов реакции из реакционной зоны.
Установившаяся суммарная скорость коррозионного процесса, состоящего из нескольких последовательных стадий, определяется скоростью самой заторможенной стадии.
При параллельном протекании отдельных стадий процесса суммарная скорость коррозии определяется самой быстрой стадией. Поэтому в случае, если одна из стадий протекает значительно быстрее другой, второй стадией можно пренебречь.
Классификация процессов коррозии
Независимо от огромного разнообразия условий протекания коррозионных процессов они могут быть классифицированы по двум основным признакам: по механизму протекания процесса и по характеру коррозионного разрушения.
Классификация процессов коррозии по механизму протекания
Различают химическую и электрохимическую коррозию. Химическая коррозия имеет место в жидких неэлектролитах и в сухих газах. При воздействии на металлы водных растворов электролитов и влажных газов коррозия протекает по электрохимическому механизму.
Отличительными особенностями электрохимического процесса коррозии являются следующие:
1. одновременное протекание двух раздельных процессов - окислительного (растворение металла) и восстановительного (выделение водорода, восстановление кислорода, выделение металла из раствора и др.);
2. процесс растворения металла сопровождается направленным перемещением электронов в металле и ионов в электролите, т.е. возникновением электрического тока;
3. продукты коррозии образуются в результате вторичных реакций.
Окислительно-восстановительные процессы, протекающие при электрохимической коррозии, могут быть представлены в виде следующих реакций:
Ме → Ме n+ + ne ( анодный процесс) (1)
ox + ne → mred (катодный процесс), (2)
где ox – окислитель;
red – его восстановленная форма;
е – электроны;
m, n – стехиометрические коэффициенты.
В качестве примера электрохимической коррозии можно привести процесс ржавления железа под воздействием воды:
Fe → Fе 2+ + 2е (анодный процесс – растворение железа)
2е + H2O +1\2О2 → 2OH– (катодный процесс – восстановление кислорода)
Fe 2+ + 2OH– → Fe(OH)2 (образование продуктов коррозии)
Реакции 1 и 2 протекают сопряженно, но подчиняются своим кинетическим закономерностям. При этом необходимо соблюдение условий стационарности процесса, т.е. равенства скоростей окисления металла и восстановления окислителя. Реакции 1 и 2 могут быть территориально разделены – протекать на разных участках поверхности. Из условий стационарности вытекает, что достаточно затормозить одну из сопряженных реакций, чтобы скорость всего процесса уменьшилась.
Если среда не является электролитом (сухие газы или жидкие неэлектролиты), то обмен электронами совершается непосредственно между металлом и окислителем по реакции:
mMe + nox → Me m(red)n (3)
В данном случае окисление совершается по химическому механизму.
 2018-01-08
2018-01-08 3551
3551







