Влияние различных факторов на состояние равновесия качественно описывается принципом смещения равновесия, сформулированным французским физико - химиком Анри Ле Шателье: eсли на систему, находящуюся в равновесии производится какое-либо воздействие (изменяется концентрация, температура, давление), то равновесие смещается в направлении процесса, ослабляющего произведенное воздействие.
Поясним на примере реакции синтеза аммиака:
(N2) + 3 (H2) 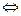 2 (NH3) DH0 = - 46кДж/моль
2 (NH3) DH0 = - 46кДж/моль
1)При увеличении концентрации хотя бы одного из реагентов равновесие смещается в сторону образования продуктов, а при добавлении продуктов – в сторону реагентов. Если увеличить концентрацию азота или водорода, то равновесие сместится вправо, в сторону расходования реагентов, в сторону уменьшения концентрации этих веществ. Увеличение концентрации NH3 сместит равновесие влево.
2)Повышение температуры вызывает смещение равновесия в сторону эндотермической реакции, а понижение - в сторону экзотермической. Реакция синтеза аммиака идет с выделением тепла (экзотермическая), поэтому повышение Т смещает равновесие влево, а понижение- вправо. Однако в промышленных условиях синтез аммиака проводят при довольно высоких температурах т.к. при низких Т хотя и достигается больший выход целевого продукта, но скорость установления равновесия настолько мала, что экономичнее синтезировать аммиак с меньшим выходом, но за более короткий срок. Но снижение выхода компенсируется увеличением давления. Одновременное повышение t до 450-5500С и увеличение давления от 15 до100мПа ускоряет процесс достижения равновесия и увеличивает выход продукта.
3)Повышение давления в равновесной системе вызывает реакцию, сопровождающуюся уменьшением числа частиц в газовой фазе, равновесие смещается в сторону меньшего числа газообразных частиц.
В данной реакции увеличение давления сместит равновесие вправо, а уменьшение - влево.
Принцип Ле Шателье применим не только к гомогенным системам, но и к гетерогенным. Гомогенные реакции протекают в однофазной системе и во всем объеме, гетерогенные - в многофазной, на поверхности раздела фаз.
В качестве примера рассмотрим гетерогенную реакцию восстановления оксида углерода (IV).
С(тв) + СО2(г) 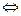 2СО(г) DH0 = 172,46 кДж
2СО(г) DH0 = 172,46 кДж
1)Увеличение концентрации СО2(г) сместит равновесиевправо, а СО влево.
2)Поскольку процесс эндотермический, то нагревание сместит равновесие вправо, в сторону увеличения выхода СО, а ее охлаждение - влево.
3)Повышение давления будет препятствовать протеканию прямого процесса, уменьшение - способствовать ему.
З.д.м. применим к гетерогенным системам лишь с определенными допущениями. Рассмотрим гетерогенную реакцию термической диссоциации карбоната кальция.
CaCO3(тв) = CaO(тв) + СО2(г)
Если бы она протекала как гомогенная, то К = [CаО ] · [CО2] / [CаСО3], но [CаО] и [CаСО3] при данной температуре величины постоянные, очень малы.
Тогда k1 = К ·[CаCО3] / [CaO] и k1 = [CО2] равновесная концентрация [CО2] при данной температуре является величиной постоянной, не зависящей от количеств CаО и CаСО3.
 2015-03-08
2015-03-08 1013
1013
