Необратимыми называются реакции, которые протекают только в одном направлении и идут до конца. Различают практически и совершенно необратимые реакции. В практически необратимых преобладает реакция, идущая в одном направлении. Среди них выделяют несколько типов:
1.Реакции двойного обмена с образованием малорастворимого вещества
NaCl + AgNO3 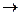 NaNO3 + AgCl
NaNO3 + AgCl 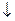
С1- + Ag+ 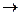 AgCI
AgCI 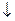
2.Реакции с образованием газообразных веществ
Na2CO3 +  2HCl
2HCl 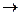 2NaCl + H2O + СO2
2NaCl + H2O + СO2 
CО32- + 2Н+ 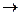 H2O + СO2
H2O + СO2 
3.Реакции с образованием малодиссоциирующих веществ
HNO3 + KOH  KNO3 + H2O
KNO3 + H2O
Н+ + ОН- = H2O
4.Ионные реакции окисления – восстановления
Zn + H2SO4  ZnSO4 + H2
ZnSO4 + H2 
Zn + 2H+  Zn+2 + H2
Zn+2 + H2 
5.Реакции, приводящие к образованию комплексных соединений
CuSO4 + 4NH4OH = [Cu(NH3)4]SO4 + 4H2O
Сu2+ + 4NH4OH = [Cu(NH3)4] 2+ + 4H2O
6.Реакции, сопровождающиеся выделением большого количества энергии
C6H12O6 + 6O2 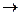 6СO2 + 6H2O
6СO2 + 6H2O  H0= -2867кДж/моль
H0= -2867кДж/моль
Примеры совершенно необратимых процессов:
2КClO3 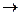 2KCl + 3O2
2KCl + 3O2
Pb(N3)2 
 Pb + 3N2
Pb + 3N2
(азид свинца)
(в обычных условиях нельзя получить бертолетову соль непосредственно из KCl и О2),а также нельзя провести синтез азида свинца из азота и свинца.
Обратимыми называются реакции, которые протекают в противоположных направлениях и не идут до конца. Примеры обратимых реакций:
N2 + 3H2 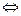 2NH3
2NH3
C + CO2 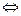 2CO
2CO
N2 + O2 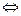 2NO
2NO
H2 + J2 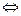 2HJ
2HJ
PCl5 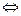 PCl3 + Cl2
PCl3 + Cl2
CO + Cl2 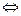 COCl2 (фосген)
COCl2 (фосген)
2NO + O2 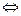 2NO
2NO
{CH3COOH} + {C2H5OH}  {CH3COOC2H5} + {H2O}- реакция этерификации (гидролиза) является равновесной, этерификация уксусной кислоты этанолом с получением этилацета,который гидролизуется водой до уксусной кислоты и этанола.
{CH3COOC2H5} + {H2O}- реакция этерификации (гидролиза) является равновесной, этерификация уксусной кислоты этанолом с получением этилацета,который гидролизуется водой до уксусной кислоты и этанола.
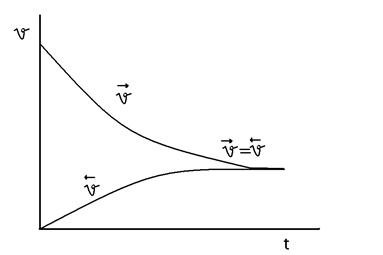
В ходе реакции устанавливается подвижное химическое равновесие, при котором скорости прямой и обратной реакции равны. Такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой называется химическим равновесием.
Для реакции в общем виде mA + nB  pС + gD скорости прямой и обратной реакций описываются следующими кинетическими уравнениями
pС + gD скорости прямой и обратной реакций описываются следующими кинетическими уравнениями
→
v1  = к1 · [A] m · [B] n
= к1 · [A] m · [B] n
←
v2 = k2 · [C] p · [D] g
Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными, обозначаются при помощи квадратных скобок, в отличии от неравновесных. → ←
В состоянии динамического равновесия v1 = v2 - кинетическая концепция равновесия. С течением времени v1 уменьшается, а v2- увеличивается. В некоторый момент они становятся равными.
k1 · [A]m · [B]n = k2· [C]p · [D]g
разделив обе части уравнения на k2, получим
Кс = k1/k2 = [ C]p · [D]g/ [A]m · [B]n
Этим выражением определяется классическая константа равновесия Кс обратимого процесса, она равна отношению констант прямой и обратной реакций Кс = k1/k2
Константа Кс, отражающая соотношение концентраций компонентов обратимой реакции в состоянии динамического равновесия называется константой равновесия.
Кс = [C]p · [D]g/ [A]m · [B]n –
 2015-03-08
2015-03-08 1875
1875
