Качество воды, используемой для бытовых и технических целей, определяется соответствующими физическими и химическими показателями в зависимости от присутствия тех или иных примесей в воде. Главные химические характеристики воды – жесткость, окисляемость, содержание хлорид-иона, оксида углерода (IV), общее солесодержание.
Анализируют воду по указанным показателям как до очистки, так и после нее.
Цель работы: определить химическую характеристику воды.
Реактивы: раствор соляной кислоты с концентрацией 0,1 моль/л, индикатор – метиловый оранжевый.
Оборудование: конические колбы на 250 мл (2 шт.), бюретка на 25 мл, цилиндр на 100 мл.
1. Жесткость воды.
Соли, присутствующие в воде, вызывают ее жесткость. Различают временную (карбонатную) жесткость, которая обусловлена наличием гидрокарбонатных солей кальция и магния, и постоянную, которая характеризуются присутствием сульфатов, хлоридов и нитратов кальция и магния. Сумма временной и постоянной жесткости дает общую жесткость воды. Жесткость воды в соответствии со стандартом (СЭВ 1052 - 78) выражается в моль/л.
Определение временной жесткости воды.
Временную жесткость воды определяют титрованием пробы исследуемой воды раствором соляной кислоты:
(Са, Mg)(HCО3)2 + 2НС1 → (Са, Mg)Cl2 + 2Н2О + 2СО2.
Расчет ведут по формуле:
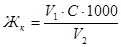 , где
, где
Жк – временная жесткость воды, ммоль/л;
V1 – объем соляной кислоты, затраченный на титрование, мл;
V2 – объем воды, взятый для анализа, мл;
С – концентрация раствора соляной кислоты, моль/л.
Порядок выполнения работы: в коническую колбу отбирают 100 мл анализируемой воды и титруют раствором соляной кислоты с индикатором – метиловым оранжевым до появления розового окрашивания.
Определение жесткости воды.
Общую жесткость воды определяют методом комплексометрического титрования, основанного на образовании прочного соединения трилона Б с ионами кальция и магния. Титрование воды проводят в присутствии индикаторов-хромогенов в слабощелочной среде, которую создают буферным раствором, содержащим NH4OH и NH4Cl (аммиачная смесь).
При этом ионы Са2+ и Mg2+ связываются с трилоном Б в комплексное соединение.
Изменение окраски индикатора от красно-фиолетовой до сине-фиолетовой свидетельствует о полном связывании в воде трилоном Б ионов кальция и магния.
Общую жесткость воды рассчитывают по формуле:
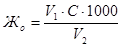 , где
, где
Жо – общая жесткость воды, ммоль/л;
V1 – объем соляной кислоты, затраченный на титрование, мл;
V2 – объем воды, взятый для анализа, мл;
С – концентрация раствора соляной кислоты, моль/л.
Реактивы: раствор трилона Б с концентрацией 0,05 ммоль/л, буферный раствор, индикатор – хромоген синий или черный, сульфид натрия, раствор солянокислого гидроксиламина 1%-ный, раствор ZnCl2 (0,05 моль/л) и сульфата магния (0,25 моль/л).
Оборудование: конические колбы на 250 мл, бюретки на 25 мл, пипетки на 100 мл, цилиндры мерные на 25 мл.
Порядок выполнения работы: в колбу вносят 100 мл анализируемой воды. Затем прибавляют 5 мл буферного раствора, 5-7 капель индикатора и сразу титруют при сильном взбалтывании раствора трилона Б до изменения окраски в эквивалентной точке.
Если на титрование израсходовано больше 10 мл раствора трилона Б, то это указывает, что в отмеренном объеме воды суммарное содержание ионов Са2+ и Mg2+ больше 5 ммоль/л. В таких случаях определение следует проводить, взяв меньший объем воды и разбавить его до 100 мл дистиллированной водой.
2. Окисляемость воды.
Окисляемость воды обуславливается присутствием в воде органических примесей. Под окисляемостью воды понимают массу кислорода в миллиграммах, идущую на окисление органических веществ, растворенных в 1 л воды при определенных условиях.
Определение окисляемости воды.
Окисляемость воды определяют методом перманганатометрии. При этом окисляются только легко окисляющиеся органические примеси. Для получения более точных результатов используют обратное титрование избытка перманганата калия. К прокипяченной пробе прибавляют избыток щавелевой кислоты, при этом часть ее окисляется оставшимся перманганатом калия, а остальное количество щавелевой кислоты оттитровывают перманганатом калия.
Реактивы: раствор перманганата калия 0,002 моль/л, щавелевой кислоты 0,005 моль/л, серной кислоты
2,5 моль/л.
Оборудование: колбы конические на 250 мл (2 шт.), бюретки градуированные (2 шт.).
Порядок выполнения работы: в коническую колбу отмеривают пипеткой 100 мл дистиллированной или отстоянной водопроводной воды, прибавляют 5 мл серной кислоты и 10 мл перманганата калия. Пробу закрывают воронкой, смесь кипятят 10 мин, считая с момента закипания. Чтобы не было бурного кипения, в колбу помещают стеклянные капилляры. К горячей окрашенной жидкости прибавляют 10 мл раствора щавелевой кислоты и перемешивают. Горячий обесцвеченный раствор титруют раствором перманганата калия до появления слаборозового окрашивания, не исчезающего 2-3 минуты.
Если при титровании после ведения в исследуемую воду щавелевой кислоты расход перманганата калия будет более 5 мл, анализ следует повторить с предварительным разбавлением исследуемой воды. При этом необходимо определить окисляемость дистиллированной воды, а также учесть кратность разбавления. Окисляемость воды (в пересчете на кислород) рассчитывают по формуле:
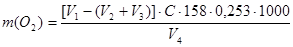 , где
, где
V1 – общий объем раствора перманганата калия, добавленного в пробу, мл;
V2 – объем раствора перманганата калия, идущий на окисление органических веществ в воде, добавленный в пробу для разбавления исследуемой воды, мл;
V3 – объем перманганата калия, идущего на окисление 10 мл щавелевой кислоты, мл;
V4 – объем исследуемой воды, мл;
С – концентрация перманганата калия, моль/л;
158 – молярная масса KMnO4, г/моль;
0,253 – коэффициент пересчета окисляемости воды на кислород.
Пример расчета. Исследуемая вода разбавлена в 10 раз (1 объем исследуемой воды и 9 объемов дистиллированной воды), окисляемость полученной смеси, вычисленная по приведенной формуле, составляет 8,4 мг/л О2.Окисляемость дистиллированной воды равна 0,4 мг/л О2. Следовательно, окисляемость исследуемой воды составляет:
8,4 – 0,4∙0,9 = 8,04 мг/л О2
Ответ: 8,04 мг/л О2.
3. Определение хлорид-иона в воде.
Определение проводят в водопроводной отстоянной воде.
Метод основан на осаждении хлорид-иона в нейтральной или слабощелочной среде нитратом серебра в присутствии дихромата калия в качестве индикатора. Изменение окраски индикатора от лимонно-желтой до оранжево-желтой свидетельствует о выделении хлорида серебра и образовании хромата серебра. Содержание хлорид-ионов вычисляют по формуле:
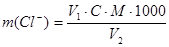 , где
, где
V1 – объем 0,02 молярного нитрата серебра, израсходованного на титрование, мл;
V2 – объем воды взятой на анализ, мл;
С – концентрация раствора нитрата серебра, моль/л;
М – молярная масса хлорид-иона, г/моль.
Реактивы: 0,02 молярный AgNО3, индикатор – дихромат калия.
Оборудование: конические колбы на 250 мл (2 шт), бюретка на 25 мл.
Порядок выполнения работы: в две колбы отмеривают по 100 мл исследуемой воды, рН которой должен быть в пределах 6-10. В пробы добавляют по 1 мл раствора дихромата калия и титруют раствором нитрата серебра до появления оранжево-желтого оттенка.
4. Определение содержания диоксида углерода.
Определение проводят в водопроводной отстоянной воде.
Содержание диоксида углерода рассчитывают по формуле:
 , где
, где
V – объем раствора гидроксида натрия, израсходованного на титрование пробы, мл;
V1 – объем воды, взятой на анализ, мл;
С – концентрация гидроксида натрия, моль/л;
М – молярная масса СО2 г/моль.
Реактивы: 0,1 молярный раствор гидроксида натрия; индикатор – 1%-ный раствор фенолфталеина.
Оборудование: коническая колба на 250 мл, бюретка на 25 мл.
Порядок выполнения работы: в коническую колбу отмеривают 250 мл исследуемой воды, прибавляют 0,2 мл фенолфталеина и перемешивают. Сравнивают полученную окраску с контрольным раствором. Если она более интенсивна, то вода содержит СО2. Если вода не окрасилась или окраска слабее эталона, то раствор титруют 0,1 молярным раствором NaOH до окраски контрольного раствора.
5. Определение содержания сульфидов воде.
Определение проводят в негазированной минеральной воде.
В этом методе сульфид-ионы осаждают в виде сульфида цинка или сульфида кадмия, отфильтровывают и промывают. Содержание сульфид-ионов в осадке находят йодометрическим методом. Содержание сульфид-ионов рассчитывают по формуле:
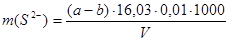 , где
, где
а – объем прибавленного раствора йода, мл;
b – объем раствора Na2S2О3, израсходованного на титрование избытка I2, мл;
16,03 – эквивалент иона;
0,01 – нормальность титрующих растворов;
V – объем пробы.
Реактивы: суспензия карбоната кадмия или карбоната цинка; отдельно готовят 10 мл растворов сульфатов цинка или кадмия и 10 мл карбоната натрия (перед применением быстро смешивают эти растворы); соляная кислота – 1:9; 0,1 нормальные растворы Na2S2О3 и йода; 0,5%-ный раствор крахмала.
Оборудование: коническая колба на 250 мл, мерная колба на 200 мл, химический стакан, воронка, фильтры, стеклянная палочка, бюретка на 25 мл.
Ход определения: в коническую колбу емкостью 250 мл наливают 25-50 мл пробы, смесь разбавляют приблизительно до 150 мл дистиллированной водой. Затем прибавляют 20 мл суспензии, хорошо перемешивают и фильтруют. Осадок промывают горячей водой. Фильтр с осадком помещают в коническую колбу емкостью 250 мл, прибавляют 25-50 мл раствора йода и подкисляют жидкость 5 мл соляной кислоты. Фильтр измельчают стеклянной палочкой и оттитровывают избыток йода раствором Na2S2О3 в присутствии крахмала.
6. Определение сухого остатка (солесодержание).
Сухой остаток – это масса остатка, получаемого выпариванием профильтрованной пробы сточной воды и высушиванием при 103-105 °С или 178-182 °С. Величина эта должна выражать суммарное количество растворенных в пробе органических и неорганических веществ.
Если остаток высушивается при 103-105 °С, то в нем сохранится вся или почти вся кристаллизационная вода солей, образующих кристаллогидраты.
Если остаток высушивается при 178-182 °С, то вода будет удалена полностью, но некоторое количество кристаллизационной воды может остаться, особенно когда в пробе присутствуют преимущественно сульфаты. Гидрокарбонаты превратятся в карбонаты, но последние могут частично разложиться с образованием оксидов или оксосолей. Может произойти частичная потеря нитратов. Органические вещества теряются в большей мере, чем неорганические.
Оборудование: стакан или колба, воронка, фильтры, фарфоровая чашка, мерная колба на 50-100 мл, щипцы, электроплитка, водяная баня, сушильный шкаф.
Порядок выполнения работы: в прокаленную, охлажденную и взвешенную фарфоровую чашку помещают 50-250 мл анализируемой воды, предварительно профильтрованной. Воду выпаривают на электроплитке досуха, затем переносят в сушильный шкаф и высушивают при 103-105 °С или 178-182 °С до постоянной массы.
Содержание сухого остатка в мг/л рассчитывают по формуле:
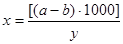 , где
, где
а – масса чашки с сухим остатком, мг;
b – масса пустой чашки, мг;
у – объем анализируемой воды, мл.
Лабораторная работа №2
 2015-03-08
2015-03-08 1799
1799
