Процесс окисления аммиака протекает одновременно и необратимо в трех направлениях с образованием нитрозного газа, содержащего азот, оксид азота (I) и оксид азота (II). Для увеличения выхода оксида азота (П) применяют катализаторы: в промышленности – дорогой платинородиевый, в лаборатории – дешевые железохромовый, хромовый, ванадиевый и другие, приготовленные на основе оксидов этих металлов.
Оксид азота (II) при охлаждении превращается в оксид азота (IV), который поглощается водой с образованием азотной и азотистой кислот. По мере накопления азотной кислоты неустойчивая азотистая кислота разлагается на оксид азота (II) и азотную кислоту. При избытке кислорода весь оксид азота (II) превращается в азотную кислоту.
Цель работы: получить водный раствор азотной кислоты окислением аммиака.
Реактивы: 25% раствор аммиака, KMnO4 или КСlO3 с МnО2, катализатор – оксид хрома (III), лакмус.
Оборудование: хлоркальциевая трубка (2 шт.), прибор для получения кислорода, колба на 250 мл, спиртовки (2 шт),,физический штатив с двумя лапками и кольцами, резиновая груша, вата, асбест.
П орядок выполнения работы: собирают установку по схеме, представленной на рисунке 7.
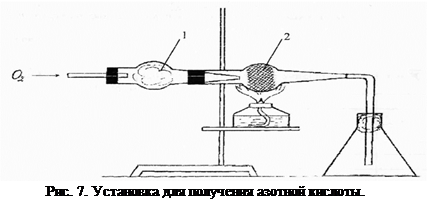 |
1- хлоркальциевая трубка с ватой, пропитанной 25%-ным раствором аммиака;
2 – хлоркальциевая трубка с катализатором (смесь Cr2O3 c с асбестом).
В хлоркальциевую трубку 1 помещают вату, смоченную 25%-ным раствором аммиака. Эту трубку соединяют с прибором для получения кислорода. В трубку 2 вначале помещают маленький кусочек стекловаты, затем ее заполняют катализаторной смесью (1/3 объема асбеста и 2/3 объема оксида хрома (III)) рыхлым слоем без просветов, для поддержания которого снова используют кусочек стекловаты. Катализаторная трубка 2 сообщается с колбой, заполненной наполовину водой, в которую добавлено несколько капель лакмуса. Лабораторную работу начинают с прогревания катализатора в течение 5-7 минут на спиртовке, после чего начинают пропускать кислород, полученный разложением перманганата калия или бертолетовой соли. Пары аммиака, захваченные током кислорода, окисляются на катализаторе, образуя нитрозный газ, который частично абсорбируется водой в колбе. Об образовании азотной кислоты судят по изменению окраски лакмуса с фиолетового на красный.
Для того, чтобы закончить работу, необходимо вначале отсоединить колбу, а затем погасить спиртовки, в противном случае воду затянет в катализаторную трубку, и она лопнет.
Оформление результатов работы.
1. Напишите уравнения реакций образования основных и побочных продуктов.
2. Опишите наблюдаемые явления.
Вопросы семинара по теме: "Аммиак и азотная кислота"
1. Проблема связывания азота и его значение в современном мире.
2. Прямой синтез аммиака из азота и водорода, влияние температуры и давления на течение реакции.
3. Катализаторы, используемые для синтеза аммиака, их роль в ускорении процесса и принцип действия.
4. Окисление аммиака: направление реакции и образующиеся соединения.
5. Катализаторы, применяемые для окисления аммиака, характер их влияния на образование оксида азота (II).
6. Влияние температуры, давления и состава воздушноаммиачной смеси на окисление аммиака.
7. Оптимальные условия окисления оксида азота (II), состав нитрозных газов.
8. Адсорбция нитрозных газов водой, условия концентрирования азотной кислоты.
Лабораторная работа № 11
 2015-03-08
2015-03-08 1628
1628








