Центральное положение атомов углерода в периодической системе приводит к тому, что он не склонен ни терять, ни присоединять электроны, а способен отдавать свои электроны на образование прочных ковалентных связей, как с элементами легко их отдающими, так и с элементами легко их присоединяющими.
Процесс образования ковалентной связи сводится к переходу электрона с атомных орбиталей на молекулярную орбиталь с меньшей энергией, то есть этот переход энергетически выгоден.
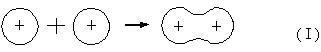
ψА ψВ ψ=(ψА + ψВ)
Новая молекулярная орбиталь является линейной комбинацией двух атомных орбиталей. Образование связей С − С и С − Н аналогично схеме.
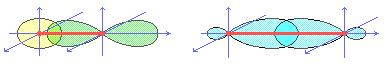
Образовавшиеся связи называются δ-связями. Они характеризуются симметрией вдоль оси, связывающей ядра атомов, в поперечном сечении имеют круг.
Ковалентная связь характеризуется полярностью, поляризуемостью, энергией и длиной связи. Полярность связи указывает на распределение электронной плотности между атомами и обозначается через -δ.
Н
+δ -δ |
СН3: Cl Н ― С+δ ― Сl-δ
|
Н
В органической молекуле полярность одной связи индуцирует (образует) в соседних связях дипольные моменты различной величины. Это явление называется индукционным эффектом (I).
Если в результате индукционного эффекта электронная плотность на молекуле снижается, то этот индукционный эффект называется отрицательным индукционным эффектом и обозначается через (-I).
-δ +δ1 +δ2 +δ3 +δ4
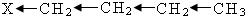
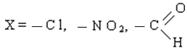
+δ1 › +δ2 › +δ3 › +δ4
Если в результате действия индукционного эффекта электронная плотность на молекуле увеличивается, то этот индукционный эффект называется положительным и обозначается через (+I).
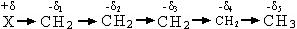 .
.
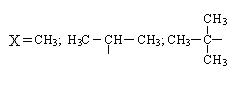
 2015-03-20
2015-03-20 911
911








